Giải Hoá 10 (Chân trời sáng tạo) Bài 2: Thành phần của nguyên tử
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 2: Thành phần của nguyên tử sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 2. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 2: Thành phần của nguyên tử
Video giải Hóa lớp 10 Bài 2: Thành phần của nguyên tử
Lời giải:
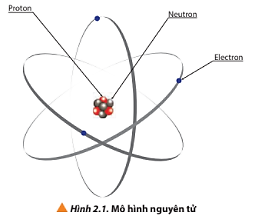
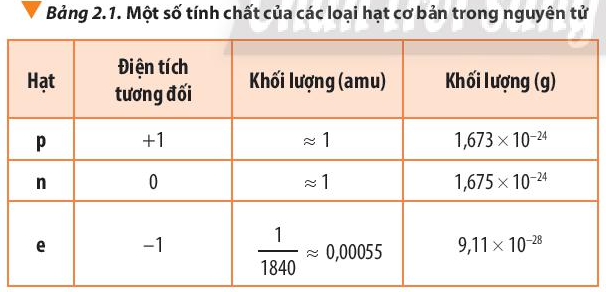
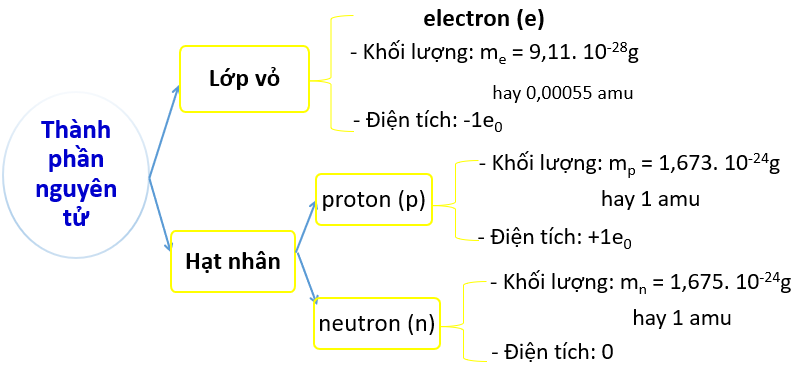
- Nguyên tử gồm các hạt cơ bản: proton, electron và neutron.
- Cơ sở để phát hiện ra các hạt cơ bản trên là:
+ Thông qua thí nghiệm phóng điện trong một ống thủy tinh gần như chân không Thomson đã phát hiện ra hạt electron.
+ Khi bắn phá hạt nhân nguyên tử nitrogen bằng các hạt α, Rutherford đã phát hiện ra hạt proton.
+ Khi dùng các hạt α bắn phá hạt nhân nguyên tử beryllium, J. Chadwick đã phát hiện hạt neutron.
1. Thành phần cấu tạo nguyên tử
Lời giải:
Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
2. Sự tìm ra electron
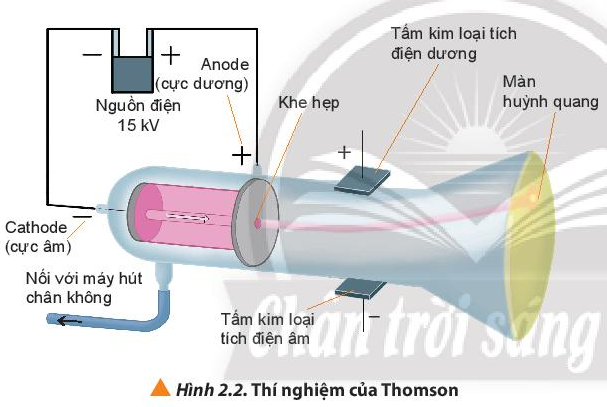
Câu hỏi 2 trang 14 Hóa học 10: Cho biết vai trò của màn huỳnh quang trong thí nghiệm ở hình 2.2.
Lời giải:
Màn huỳnh quang dùng để hứng các tia phát ra từ cực âm. Cụ thể màn huỳnh quang phát sáng do sự xuất hiện các tia không nhìn thấy được đi từ cực âm đến cực dương.
Lời giải:
Tia âm cực mang điện âm nên bị hút về cực dương của trường điện.
Lời giải:
Nếu đặt một chong chóng nhẹ trên đường đi của tia âm cực thì chong chóng sẽ quay. Từ hiện tượng này cho thấy tia âm cực là chùm hạt vật chất chuyển động với vận tốc rất lớn.
3. Sự khám phá hạt nhân nguyên tử
Lời giải:
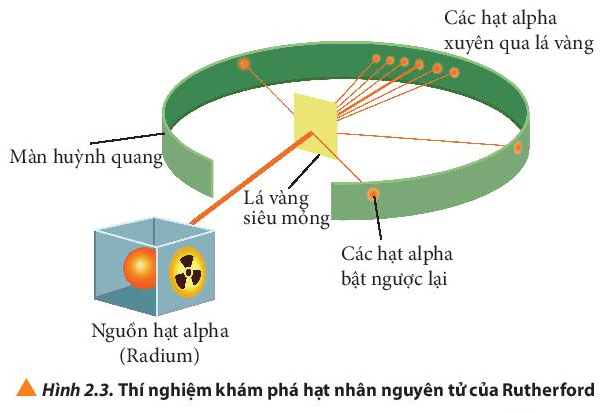
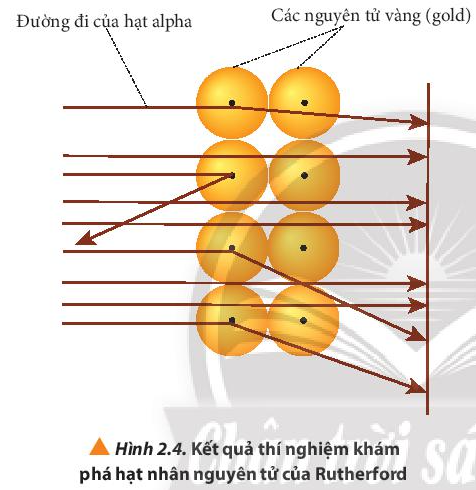
- Hình 2.3 cho thấy: Hầu hết các hạt alpha đều xuyên thẳng qua lá vàng, một số ít bị lệch hướng và một số rất ít bị bật ngược lại.
- Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.
Lời giải:
Nguyên tử trung hòa về điện: Số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
⇒ Điện tích hạt nhân của nguyên tử oxygen là +8.
4. Cấu tạo hạt nhân nguyên tử
Lời giải:
Điện tích của hạt nhân nguyên tử do proton quyết định.
Số đơn vị điện tích hạt nhân bằng số proton trong hạt nhân.
Lời giải:
Điện tích hạt nhân là +11 nên số proton là 11.
Nguyên tử trung hòa về điện: Số electron = số proton = 11.
5. Kích thước và khối lượng nguyên tử
Lời giải:
Ta có:
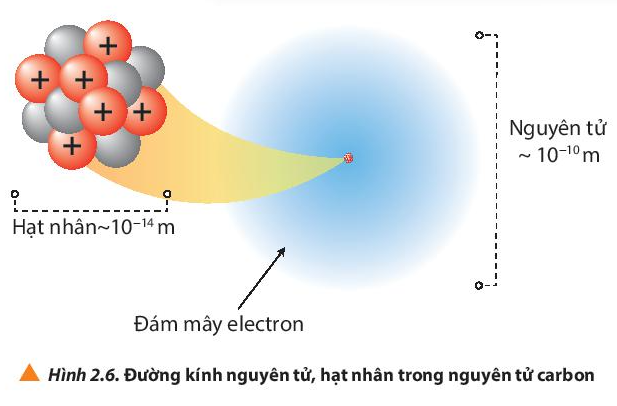
Nhận xét: Đường kính nguyên tử lớn hơn đường kính hạt nhân khoảng 10 000 lần.
Trả lời:
Ta có:
= 1840 (lần)
Kết quả này cho thấy khối lượng của các hạt electron không đáng kể so với khối lượng của proton và neutron, do đó khối lượng của nguyên tử gần bằng khối lượng của hạt nhân.
Lời giải:
1 amu = 1,66.10-24 g
Một cách gần đúng, khối lượng của nguyên tử oxygen là:
mnt = mp + mn = 8 + 8 = 16 amu = 2,656.10-23 gam.
Lời giải:
Bài tập (trang 19)
Lời giải:
Dữ kiện trong thí nghiệm của Rutherford chứng minh nguyên tử có cấu tạo rỗng: hầu hết các hạt alpha đều xuyên thẳng qua lá vàng.
Giải thích: Do nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương có kích thước rất nhỏ so với kích thước nguyên tử nên hầu hết các hạt alpha có thể đi xuyên qua lá vàng.
Bài 2 trang 19 Hóa học 10: Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu.
B. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu.
C. Neutron không mang điện, khối lượng gần bằng 1 amu.
Lời giải:
Đáp án đúng là: B
B không đúng do hạt electron nằm ở vỏ nguyên tử.
Bài 3 trang 19 Hóa học 10: Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?
b) Hạt được tìm thấy trong hạt nhân và không mang điện.
Lời giải:
a) Hạt mang điện tích dương: proton.
b) Hạt được tìm thấy trong hạt nhân và không mang điện: neutron.
c) Hạt mang điện tích âm: electron.
Bài 4 trang 19 Hóa học 10: a) Cho biết 1 g electron có bao nhiêu hạt?
b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022×1023).
Lời giải:
a) Vì 1 hạt electron nặng 9,11×10-28 g nên 1 g electron có số hạt là:
≈ 1 × 1027 (hạt)
b) 1 mol electron có chứa số hạt là 6,022 × 1023 hạt
Do đó 1 mol electron có khối lượng là:
6,022 × 1023 × 1 × 9,11 × 10-28 = 5,486 × 10-4 (g).