Tính nhiệt tạo thành chuẩn của HF và NO dựa vào năng lượng liên kết
Lời giải Bài 14.5 trang 57 SBT Hóa học 10 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải SBT Hóa học 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 14.5 trang 57 SBT Hóa học 10. Tính nhiệt tạo thành chuẩn của HF và NO dựa vào năng lượng liên kết (Bảng 14.1 SGK), của F2, H2, HF, N2, O2, NO. Giải thích sự khác nhau về nhiệt tạo thành của HF và NO.
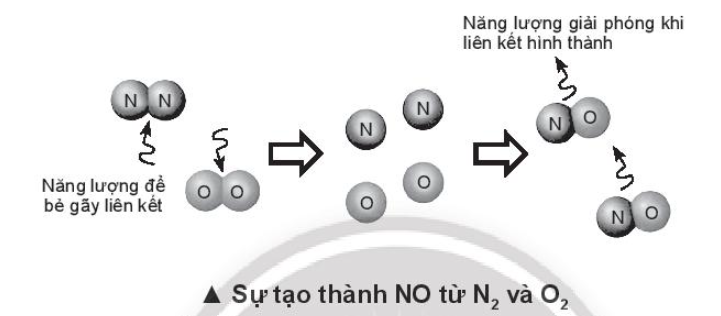
Lời giải:
Áp dụng công thức:
= 945 kJ/mol,
Eb(O=O) = 498 kJ/mol; Eb(N≡O) = 631 kJ/mol;
Nhiệt tạo thành 1 mol HF:
432 + 159 – 2.565 = -539 kJ < 0
⇒ Phản ứng xảy ra.
Nhiệt tạo thành 1 mol NO:
(NO) = 945 + 498 – 2.631 = +181 kJ > 0
⇒ Phản ứng không xảy ra
Xem thêm các bài giải sách bài tập Hóa học 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 14.4 trang 56 SBT Hóa học 10. Propene là nguyên liệu cho sản xuất nhựa polypropylene (PP)...
Bài 14.7 trang 57 SBT Hóa học 10. Kim loại nhôm có thể khử được oxide của nhiều nguyên tố...
Bài 14.9 trang 58 SBT Hóa học 10. Cho các phản ứng:...
Bài 14.13 trang 59 SBT Hóa học 10. Cho phương trình hóa học của phản ứng:...
Bài 14.14* trang 59 SBT Hóa học 10. Cho phản ứng phân hủy hydrazine: ...
Bài 14.15 trang 59 SBT Hóa học 10. Quá trình hòa tan calcium chloride trong nước:...
Xem thêm lời giải sách bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng


