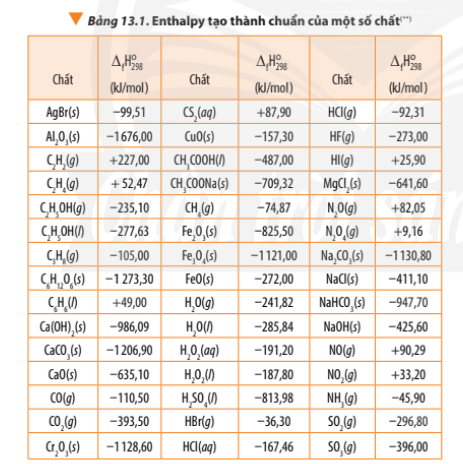
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn
Lời giải bài 2 trang 92 Hóa học 10 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 2 trang 92 Hóa học 10: Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Lời giải:
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) - ∆ f(C6H6) - ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) - .0
∆ r = -3267,52 kJ
1,0 gam C6H6(l) ứng với mol C6H6(l)
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
∆ r = 3.∆ f(CO2) + 4. ∆ f(H2O) - ∆ f(C3H8) – 5.∆ f(O2)
∆ r = 3.(-393,50) + 4.(-285,84) – (-105,00) - 5.0
∆ r = -2218,86 kJ
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2218,86 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2218,86 = 50,43 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:


