Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình
Lời giải luyện tập trang 32 Hóa học 10 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Chân trời sáng tạo Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Luyện tập trang 32 Hóa học 10: Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biểu diễn cấu hình electron của aluminium theo ô orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Lời giải:
Z = 13 ⇒ nguyên tử aluminium có 13 electron.
Cấu hình electron nguyên tử aluminium là: 1s22s22p63s23p1 hoặc viết gọn [Ne]3s23p1.
Cấu hình electron theo ô orbital:
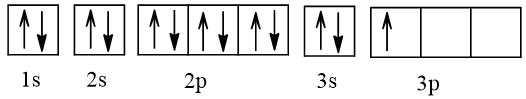
⇒ Nguyên tử aluminium có 1 electron độc thân.
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:


