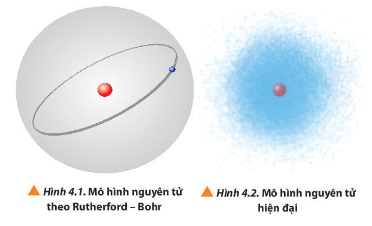
Quan sát Hình 4.1 và 4.2, so sánh điểm giống và khác nhau giữa mô hình Rutherford - Bohr
Lời giải câu hỏi 1 trang 26 Hóa học 10 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Chân trời sáng tạo Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Câu hỏi 1 trang 26 Hóa học 10: Quan sát Hình 4.1 và 4.2, so sánh điểm giống và khác nhau giữa mô hình Rutherford - Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử.
Lời giải:
|
|
Mô hình Rutherford – Bohr |
Mô hình hiện đại |
|
Giống nhau |
Electron chuyển động quanh hạt nhân |
|
|
Khác nhau |
Hạt nhân nằm ở giữa, electron chuyển động quanh hạt nhân trên quỹ đạo đường đi xác định có hình tròn hoặc hình bầu dục. |
Electron chuyển động hỗn loạn không có quỹ đạo xác định quanh hạt nhân ⇒ Chỉ xác định được khoảng không gian mà electron chuyển động trong đó, khoảng không gian đó gọi là Orbital nguyên tử. |
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Chân trời sáng tạo hay, chi tiết khác:


