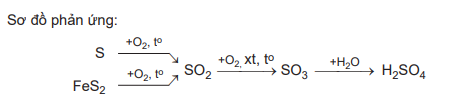Giải Hoá 10 (Kết nối tri thức) Bài 15: Phản ứng oxi hóa – khử
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 15: Phản ứng oxi hóa – khử sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 15. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 15: Phản ứng oxi hóa – khử
Mở đầu trang 71 Hóa học 10: Trong là luyện gang, xảy ra phản ứng oxi hoá – khử theo sơ đồ sau:
Lời giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
- Để lập phương trình hóa học của phản ứng oxi hóa – khử, ta áp dụng phương pháp thăng bằng electron. Nguyên tắc của phương pháp như sau:
“Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”
Phản ứng oxi hóa – khử: Fe2O3 + 3CO 2Fe + 3CO2
Có sự thay đổi số oxi hóa của các chất như sau:
I. Số oxi hóa
Câu hỏi 1 trang 73 Hóa học 10: Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:
a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4.
b) S, H2S, SO2, SO3, H2SO4, Na2SO3.
Lời giải:
a)
- Số oxi hóa của Fe đơn chất là 0
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).1 = 0 ⇒ x = +2
Vậy số oxi hóa của Fe trong hợp chất FeO là +2
- Trong hợp chất
Tổng số oxi hóa = x.2 + (-2).3 = 0 ⇒ x = +3
Vậy số oxi hóa của Fe trong hợp chất Fe2O3 là +3
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).2 + (+1).2 = 0 ⇒ x = +2
Vậy số oxi hóa của Fe trong hợp chất Fe(OH)2 là +2
- Trong hợp chất
Tổng số oxi hóa = x.3 + (-2).4 = 0 ⇒ x =
Vậy số oxi hóa của Fe trong hợp chất Fe3O4 là
b)
- Số oxi hóa của đơn chất S là 0
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x = 0 ⇒ x = -2
Vậy số oxi hóa của S trong hợp chất H2S là -2
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).2 = 0 ⇒ x = +4
Vậy số oxi hóa của S trong hợp chất SO2 là +4
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).3 = 0 ⇒ x = +6
Vậy số oxi hóa của S trong hợp chất SO3 là +6
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x.1 + (-2).4 = 0 ⇒ x = +6
Vậy số oxi hóa của S trong hợp chất H2SO4 là +6
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x.1 + (-2).3 = 0 ⇒ x = +4
Vậy số oxi hóa của S trong hợp chất Na2SO3 là +4
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử
Hoạt động trang 73 Hóa học 10: Xác định chất oxi hoá, chất khử
Chuẩn bị: đinh sắt, dung dịch CuSO4, dung dịch H2SO4 loãng, ống nghiệm.
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4.
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử.
2. Xác định chất oxi hoá, chất khử trong hai phản ứng trên.
Lời giải:
1. Viết quá trình oxi hoá, quá trình khử.
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4.
Quá trình oxi hóa:
Quá trình khử:
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4.
Quá trình oxi hóa:
Quá trình khử:
2. Xác định chất oxi hoá, chất khử trong hai phản ứng trên.
Thí nghiệm 1: Chất khử là Fe, chất oxi hóa là CuSO4.
Thí nghiệm 2: Chất khử là Fe, chất oxi hóa là H2SO4.
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa.
Lời giải:
a) Số oxi hóa của Fe tăng từ +2 lên +3.
Số oxi hóa của O (O2) giảm từ 0 xuống -2.
b) Quá trình oxi hóa:
Quá trình khử:
c)
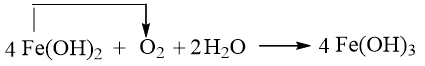
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
Câu hỏi 3 trang 75 Hóa học 10: Xét các phản ứng hóa học xảy ra trong công nghiệp:
Lời giải:
Phản ứng a) không là phản ứng oxi hóa – khử do không có sự thay đổi số oxi hóa của các nguyên tử.
Phản ứng b) là phản ứng oxi hóa – khử do có sự thay đổi số oxi hóa của các nguyên tử.
Đối với phản ứng b) C + CO2 CO
Bước 1:
Chất khử là C, chất oxi hóa là CO2.
Bước 2: Các quá trình oxi hóa, quá trình khử
Bước 3: Xác định hệ số
Bước 4: Cân bằng
C + CO2 2CO
IV. Phản ứng oxi hoá – khử trong thực tiễn
Câu hỏi 4 trang 76 Hóa học 10: Nêu một số phản ứng oxi hoá – khử có lợi và có hại trong thực tế.
Lời giải:
Một số phản ứng oxi hóa – khử có lợi trong thực tế:
- Phản ứng đốt cháy nhiên liệu (than đá, khí thiên nhiên, xăng, dầu, …) cung cấp năng lượng dưới dạng nhiệt dùng để đun nấu, sưởi ấm, chạy động cơ.
- Sản xuất hóa chất trong công nghiệp, ví dụ sản xuất sulfuric acid từ quặng pyrite.
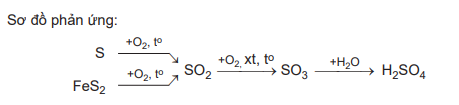
- Phản ứng chuyển hóa các chất trong tự nhiên như chuổi phản ứng:
N2 + O2 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
HNO3 tan vào nước mưa và chuyển hóa thành gốc nitrate (NO3-), cung cấp chất đạm cho cây lúa. Nhờ quá trình trên, hàng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
Một số phản ứng oxi hóa – khử có hại trong thực tế:
- Sự han gỉ kim loại.
Trong không khí ẩm, các vật dụng bằng thép vị oxi hóa tạo gỉ sắt.
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
- Mưa axit ăn mòn các công trình xây dựng, tượng đài …
Lời giải:
1) S + O2 SO2
2) 4FeS2 + 11O2 2Fe2O3 + 8SO2
3) 2SO2 + O2 2SO3
4) SO3 + H2O ⟶ H2SO4
Trong các phản ứng trên, phản ứng (1), (2), (3) là phản ứng oxi hóa khử do có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải:
Phương trình hóa học của phản ứng:
⇒ Chất oxi hóa là O2, chất khử là C2H2.
⇒ 2C2H2 + 5O2 4CO2 + 2H2O
Khí CO2 đi lên phía trên, gặp các lớp than cốc và bị khử thành CO:
Tiếp đó, khí CO khử Fe2O3 thành Fe theo sơ đồ phản ứng tổng quát:
Lập các phương trình hóa học ở trên, chỉ rõ chất oxi hóa, chất khử.
Lời giải:
- Lập phương trình: C + O2 CO2
⇒ Chất khử là C, chất oxi hóa là O2.
⇒ C + O2 CO2
- Lập phương trình: CO2 + C CO
⇒ Chất khử là C, chất oxi hóa là CO2.
⇒ CO2 + C 2CO
- Lập phương trình: Fe2O3 + CO Fe + CO2
⇒ Chất khử là CO, chất oxi hóa là Fe2O3.
⇒ Fe2O3 + 3CO 2Fe + 3CO2