Giải Hoá 10 (Kết nối tri thức) Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 6. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Video giải bài tập Hóa lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Lời giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì bán kính nguyên tử giảm theo chiều tăng của điện tích hạt nhân do lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
+ Trong một nhóm, bán kính nguyên tử tăng theo chiều tăng của điện tích hạt nhân do lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
- Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng. Do khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
- Trong một nhóm A, theo chiều tăng của điện tích hạt nhân độ âm điện giảm. Do khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
- Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần. Do bán kính nguyên tử giảm, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng, dẫn đến khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần. Tuy điện tích hạt nhân tăng, nhưng bán kính nguyên tử tăng nhanh chiếm ưu thế hơn nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dần đến khả năng nhường electron tăng. Do đó tính kim loại tăng, khả năng nhận electron giảm nên tính phi kim giảm.
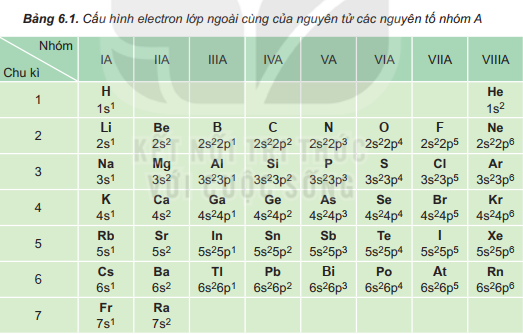
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Lời giải:
|
Nguyên tử |
Li |
Al |
Ar |
Ca |
Si |
Se |
P |
Br |
|
Số electron lớp ngoài cùng |
1 |
3 |
8 |
2 |
4 |
6 |
5 |
7 |
Lời giải:
Dựa vào bảng tuần hoàn ta xác định được:
|
|
Ô |
Chu kì |
Nhóm |
Số electron hóa trị |
|
Z = 8 |
8 |
2 |
VIA |
6 |
|
Z = 11 |
11 |
3 |
IA |
1 |
|
Z = 17 |
17 |
3 |
VIIA |
7 |
|
Z = 20 |
20 |
4 |
IIA |
2 |
II. Bán kính nguyên tử
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium (Z = 34).
Lời giải:
a) Lithium (Li) và potassium (K) cùng thuộc nhóm IA trong bảng tuần hoàn. Trong một nhóm A theo chiều tăng điện tích hạt nhân bán kính nguyên tử tăng
⇒ Bán kính nguyên tử: Li < K
Giải thích:
Trong một nhóm A, theo chiều tăng điện tích hạt nhân, số lớp electron tăng ⇒ lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dẫn đến bán kính nguyên tử tăng.
b) Calcium (Ca) và selenium (Se) cùng thuộc chu kì 4 trong bảng tuần hoàn. Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
⇒ Bán kính nguyên tử: Ca > Se
Giải thích:
Trong một chu kì, theo chiều tăng điện tích hạt nhân số electron lớp ngoài cùng tăng
⇒ Lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng dẫn đến bán kính nguyên tử giảm.
III. Độ âm điện
Lời giải:
- Ca (Z = 20) và Mg (Z = 12) cùng thuộc nhóm IIA.
Mà trong một nhóm A, khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm
⇒ Độ âm điện: Mg > Ca (1)
- Mg (Z = 12), P (Z = 15) và S (Z = 16) cùng thuộc chu kì 3.
Mà trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
⇒ Độ âm điện: Mg < P < S (2)
Từ (1) và (2) ⇒ Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca < Mg < P < S.
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử của các nguyên tố hóa học trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Lời giải:
a) Trong almelec gồm các nguyên tố: Al (Z = 13), Mg (Z = 12), Si (Z = 14)
Ta thấy ba nguyên tố này cùng thuộc chu kì 2 trong bảng tuần hoàn
Mà trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
⇒ Bán kính nguyên tử tăng dần theo thứ tự: Si < Al < Mg
b) Trong một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng.
⇒ Độ âm điện giảm dần theo thứ tự: Si > Al > Mg
IV. Tính kim loại và tính phi kim
Hoạt động 1 trang 38 Hóa học 10: So sánh tính kim loại của sodium và magnesium
Chuẩn bị: kim loại Na; Mg; dung dịch phenolphthalein; nước; cốc thủy tinh.
- Cho một mẩu nhỏ Na vào cốc (1), một dây Mg vào cốc (2).
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết phương trình hóa học của các phản ứng.
2. So sánh mức độ phản ứng của sodium và magnesium với nước.
Lời giải:
1. Phương trình hóa học của các phản ứng:
2Na + 2H2O ⟶ 2NaOH + H2↑
Mg gần như không phản ứng. Không thấy hiện tượng gì.
2. Sodium phản ứng mãnh liệt với nước.
Magnesium gần như không phản ứng với nước ở nhiệt độ thường.
Hoạt động 2 trang 38 Hóa học 10: So sánh tính kim phi của chlorine và iodine
Chuẩn bị: Hình ảnh hoặc video phản ứng của nước của chlorine với dung dịch potassium iodide (∗).
Câu hỏi: So sánh tính phi kim của chlorine và iodine.
Lời giải:
Hiện tượng: Nước chlorine phản ứng với dung dịch potassium iodide tạo dung dịch có màu nâu (do một phần iodine tan trong nước tạo dung dịch màu nâu). Một phần iodine màu đen tím rắn lắng xuống đáy ống nghiệm
Phương trình hóa học: Cl2 + 2KI → 2KCl + I2
Từ thí nghiệm trên ta thấy chlorine có tính phi kim mạnh hơn iodine nên đã đẩy iodine ra khỏi muối.
Kết luận: Chlorine có tính phi kim mạnh hơn iodine.
Lời giải:
Dựa vào bảng tuần hoàn ta thấy Ba (Z = 56), Mg (Z = 12), Ca (Z = 20), Sr (Z = 38) đều cùng thuộc nhóm IIA.
Mà trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần.
⇒ Sắp xếp theo chiều giảm dần tính kim loại: Ba > Sr > Ca > Mg
Lời giải:
Đáp án đúng là: B
Dựa vào bảng tuần hoàn ta có: O (Z = 8) và Se (Z = 34) cùng thuộc nhóm VIA
⇒ Tính phi kim O > Se (1)
F (Z = 9) và Cl (Z = 17) cùng thuộc nhóm VIIA
⇒ Tính phi kim F > Cl (2)
O (Z = 8) và F (Z = 9) cùng thuộc chu kì 2
⇒ Tính phi kim F > O (3)\
Từ (1), (2), (3) ⇒ Tính phi kim: F > O > Se và F > Cl
Vậy tính phi kim của F là mạnh nhất.