Giải Hoá 10 (Kết nối tri thức) Bài 2: Nguyên tố hoá học
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 2: Nguyên tố hoá học sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 2. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 2: Nguyên tố hóa học
Video giải bài tập Hóa lớp 10 Bài 2: Nguyên tố hóa học
Lời giải:
Các nguyên tử có cùng số đơn vị điện tích hạt nhân thuộc về cùng một nguyên tố hóa học.
Trong nguyên tử số đơn vị điện tích hạt nhân = số electron = số proton.
I. Nguyên tố hóa học
Lời giải:
L (Z = 8, A = 16) và E (Z = 8, A = 18) thuộc cùng một nguyên tố hóa học vì cùng có số đơn vị điện tích hạt nhân là 8.
II. Kí hiệu nguyên tử
Câu hỏi 2 trang 18 Hóa học 10: Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ.
Lời giải:
Kí hiệu một nguyên tử cho biết:
- Kí hiệu nguyên tố
- Số khối (A)
- Số hiệu nguyên tử (Z)
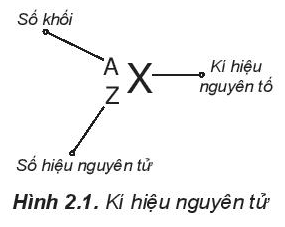
+ Từ số hiệu nguyên tử ta có thể biết được số proton, số electron nguyên tử.
Số hiệu nguyên tử (Z) = số proton = số electron.
+ Từ số khối (A) và số hiệu nguyên tử (Z) ta có thể biết được số neutron (N) theo công thức:
A = Z + N
Ví dụ: Từ kí hiệu hóa học của nguyên tử sodium là cho biết:
- Kí hiệu nguyên tố: Na
- Số khối: A = 23
- Số hiệu nguyên tử: Z = 11
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Số neutron = A – Z = 23 – 11 = 12
Câu hỏi 3 trang 18 Hóa học 10: Hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7).
b) Phosphorus (số proton = 15 và số neutron = 16).
c) Copper (đồng) (số proton = 29 và số neutron = 34).
Lời giải:
a) Nitrogen (số proton = 7 và số neutron = 7).
Số hiệu nguyên tử nitrogen = số proton = 7
Số khối của nguyên tử nitrogen A = Z + N = 7 + 7 = 14
Kí hiệu nguyên tử nitrogen:
b) Phosphorus (số proton = 15 và số neutron = 16).
Số hiệu nguyên tử phosphorus = số proton = 15
Số khối của nguyên tử phosphorus A = Z + N = 15 + 16 = 31
Kí hiệu nguyên tử phosphorus:
c) Copper (số proton = 29 và số neutron = 34).
Số hiệu nguyên tử copper = số proton = 29
Số khối của nguyên tử copper A = Z + N = 29 + 34 = 63
Kí hiệu nguyên tử copper:
III. Đồng vị
b) .
Lời giải:
Em cần nhớ: Trong nguyên tử:
+ Số hiệu nguyên tử Z = số proton = số electron.
+ A = Z + N
a)
|
|
|
|
|
|
Số proton |
14 |
14 |
14 |
|
Số electron |
14 |
14 |
14 |
|
Số neutron |
14 |
15 |
16 |
b)
|
|
|
|
|
|
|
Số proton |
26 |
26 |
26 |
26 |
|
Số electron |
26 |
26 |
26 |
26 |
|
Số neutron |
28 |
30 |
31 |
32 |
IV. Nguyên tử khối
Lời giải:
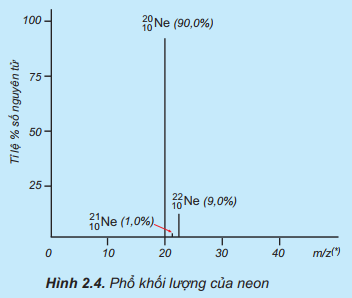
Nguyên tử khối trung bình của Ne là
Lời giải:
Chromium có 4 nguyên tử đồng vị trong tự nhiên đó là 50Cr; 52Cr; 53Crvà 54Cr với tỉ lệ phần trăm các đồng vị khác nhau.
⇒ Nguyên tử khối trung bình của chromium không phải là số nguyên mà là 51,996.
Lời giải:
Gọi phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên là x %.
⇒ Phần trăm số nguyên tử của là 100 – x (%)
Ta có:
⇒ x = 72,7%
Vậy phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên là 72,7%
Lời giải:
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
Ví dụ: Trong tự nhiên, neon (Ne) có ba đồng vị bền là
Ta xác định được:
- Mỗi đồng vị có nguyên tử khối lần lượt là 21, 20, 22
- Nguyên tử trung bình của Ne là
Lời giải:
- Nguyên tử khối của các nguyên tố hóa học không phải là các trị số nguyên vì hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị, mỗi đồng vị có tỉ lệ phần trăm số nguyên tử xác định. Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng khác nhau số neutron.