Giải Hoá 10 (Kết nối tri thức) Bài 16: Ôn tập chương 4
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 16: Ôn tập chương 4 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 16. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 16: Ôn tập chương 4
I. Hệ thống hóa kiến thức
Hoàn thành các nội dung còn thiếu trang 78 Hóa học 10:
Hoàn thành các nội dung còn thiếu sau đây:
Lời giải:
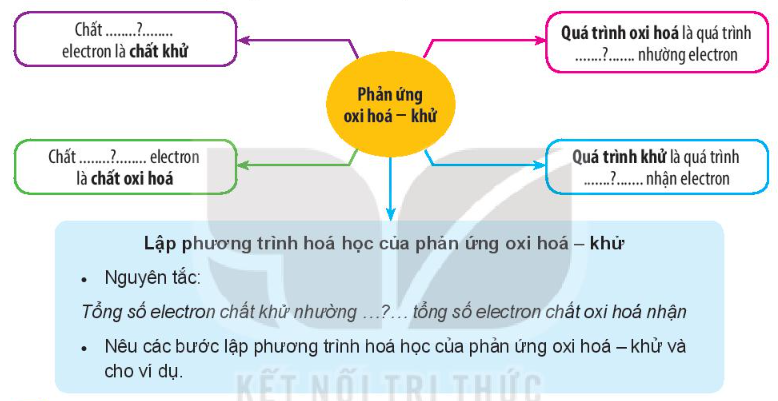
Phản ứng oxi hóa – khử
+ Chất nhường electron là chất khử.
+ Chất nhận electron là chất oxi hóa.
+ Quá trình oxi hóa là quá trình chất khử nhường electron.
+ Quá trình khử là quá trình chất oxi hóa nhận electron.
+ Lập phương trình hóa học của phản ứng oxi hóa – khử
• Nguyên tắc:
Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
• Các bước lập phương trình hóa học:
Bước 1: Xác định số oxi hóa của các nguyên tố có sự thay đổi số oxi hóa.
Xác định chất oxi hóa, chất khử.
Bước 2: Viết quá trình nhường, nhận electron.
Bước 3: Xác định hệ số.
Bước 4: Cân bằng.
Ví dụ: Lập phương trình phản ứng theo sơ đồ: C + CO2 CO
Bước 1:
Chất khử là C, chất oxi hóa là CO2.
Bước 2: Các quá trình oxi hóa, quá trình khử
Bước 3: Xác định hệ số
Bước 4: Cân bằng
C + CO2 2CO
II. Luyện tập
Câu hỏi 1 trang 78 Hóa học 10: Trong phản ứng oxi hóa - khử, chất oxi hóa là chất
Lời giải:
Đáp án đúng là: A
Trong phản ứng oxi hóa - khử, chất oxi hóa là chất nhận electron (số oxi hóa giảm sau phản ứng)
Câu hỏi 2 trang 78 Hóa học 10: Trong phản ứng hóa học: Fe + H2SO4 ⟶ FeSO4 + H2, mỗi nguyên tử Fe đã
Lời giải:
Đáp án đúng là: A
⇒ Mỗi nguyên tử sắt đã nhường 2 electron.
Câu hỏi 3 trang 78 Hóa học 10: Trong phản ứng hóa học: 2Na + 2H2O ⟶ 2NaOH + H2, chất oxi hóa là
Lời giải:
Đáp án đúng là: A
Số oxi hóa của H giảm từ +1 (trong H2O) về 0 (trong H2)
⇒ Chất oxi hóa là H2O.
Câu hỏi 4 trang 78 Hóa học 10: Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học:
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào?
Lời giải:
Đáp án đúng là: D
Quá trình trao đổi electron
Quá trình oxi hóa: 2Br- ⟶ Br2 + 2e
Quá trình khử: Cl2 + 2e ⟶ 2Cl-
⇒ Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất NaBr.
Câu hỏi 5 trang 79 Hóa học 10: Xét các phản ứng hóa học xảy ra trong các quá trình sau:
a) Luyện gang từ quặng hematite đỏ:
b) Luyện zinc (kẽm) từ quặng blend:
c) Sản xuất xút, chlorine từ dung dịch muối ăn:
d) Đốt cháy ethanol có trong xăng E5:
Lời giải:
Tất cả các phản ứng trên đều là phản ứng oxi hóa – khử.
a)
Chất khử là CO, chất oxi hóa là Fe2O3.
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
Fe2O3 + CO 2FeO + CO2
⇒ Chất khử là CO, chất oxi hóa là FeO
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
FeO + CO Fe + CO2
b) Luyện kẽm từ quặng blend:
⇒ Chất khử là ZnS, chất oxi hóa là O2.
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
2ZnS + 3O2 2ZnO + 2SO2
⇒ Chất khử là C, chất oxi hóa là ZnO.
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
ZnO + C Zn + CO
c) Sản xuất xút, chlorine từ dung dịch muối ăn:
⇒ Chất khử NaCl, chất oxi hóa là H2O.
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
2NaCl + 2H2O 2NaOH + Cl2 + H2
d) Đốt cháy ethanol có trong xăng E5:
⇒ Chất khử là C2H5OH, chất oxi hóa là O2.
- Biểu diễn quá trình oxi hóa, quá trình khử:
- Xác định hệ số
- Cân bằng
C2H5OH + 3O2 2CO2 + 3H2O
Câu hỏi 6 trang 79 Hóa học 10: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
Lời giải:
Phương trình hóa học:
Theo phương trình 1 thể tích ammonia sẽ phản ứng với = 1,25 thể tích oxygen.
⇒ Cần trộn 1 thể tích khí ammonia với thể tích không khí.
Cu + O2 + H2SO4 ⟶ CuSO4 + H2O (1)
Cu + H2SO4 (đặc) CuSO4 + SO2 + H2O (2)
Trong hai cách trên, cách nào sử dụng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn?
Lời giải:
a)
⇒ Chất oxi hóa là O2, chất khử là Cu
⇒ 2Cu + O2 + 2H2SO4 ⟶ 2CuSO4 + 2H2O
b) Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Theo phương trình hóa học:
Phản ứng (1): Cần 1 mol acid H2SO4 loãng tạo 1 mol CuSO4.
Phản ứng (2): Cần 2 mol acid H2SO4 đặc tạo 1 mol CuSO4
⇒ Cách sản xuất bằng cách ngâm đồng phế liệu trong dung dịch sulfuric acid loãng và sục không khí (phản ứng (1)) cần ít sulfuric acid hơn và cũng ít gây ô nhiễm hơn vì sản phẩm không có sinh ra khí SO2 độc hại, gây ô nhiễm.