Giải Hoá 10 (Kết nối tri thức) Bài 13: Liên kết hydrogen và tương tác Van der waals
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 13. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals
Video giải bài tập Hóa lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals
Lời giải:
Em cần nhớ:
Nhiệt độ nóng chảy và nhiệt độ sôi của một chất phụ thuộc chính vào hai yếu tố: Khối lượng phân tử và liên kết giữa các phân tử
+ Khối lượng phân tử càng lớn nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
+ Liên kết giữa các phân tử càng mạnh thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
Ta có:
- Các phân tử H2O tạo được liên kết hydrogen với nhau do trong phân tử liên kết O-H phân cực mạnh, nguyên tử O còn cặp electron chưa liên kết.
- Các phân tử H2S và CH4 không tạo được liên kết hydrogen với nhau.
⇒ Nhiệt độ sôi của H2O lớn hơn nhiều so với H2S và CH4.
- Khối lượng phân tử H2S (34 amu) lớn gần gấp đôi khối lượng phân tử của CH4 (16 amu).
- Liên kết S-H phân cực hơn liên kết C-H nên tương tác van der Waals giữa các phân tử H2S mạnh hơn tương tác van der Waals giữa các phân tử CH4.
⇒ Nhiệt độ sôi của H2S hớn hơn nhiệt độ sôi của CH4.
II. Liên kết hydrogen
Câu hỏi 1 trang 66 Hóa học 10: Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF).
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Lời giải:
a)
![]()
b)
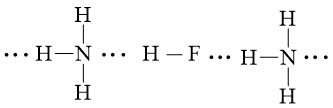
Lời giải:
Những nguyên tử H không gắn nguyên tử O thì không tham gia vào liên kết hydrogen.
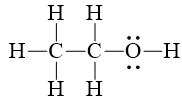
Vì để tham gia vào liên kết hydrogen, nguyên tử hydrogen phải liên kết với các nguyên tử có độ âm điện lớn như F, O, N, … và các nguyên tử tử này phải có ít nhất 1 cặp electron hóa trị chưa tham gia liên kết.
Trong phân tử ethanol chỉ có nguyên tử O còn cặp electron hóa trị chưa tham gia liên kết.
⇒ Chỉ có nguyên tử H gắn vào O trong ethanol tham gia vào liên kết hydrogen.
III. Tương tác Van der waals
Câu hỏi 3 trang 67 Hóa học 10: Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Lời giải:
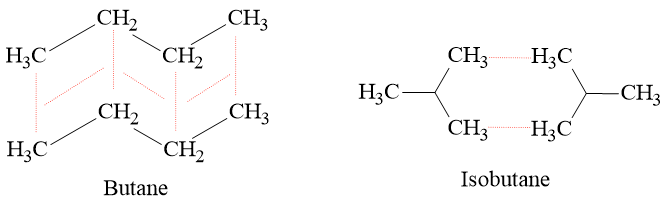
Butane và isobutane là hợp chất cộng hóa trị không phân cực và có cùng công thức phân tử là C4H10. Tuy nhiên diện tích tiếp xúc của các phân tử butane lớn hơn dẫn đến tương tác van der Waals lớn hơn so với các phân tử isobutane.
⇒ Năng lượng cần để phá vỡ lực liên phân tử (tương tác van der Waals) giữa các phân tử butane nhiều hơn isobutane nên có nhiệt độ sôi cao hơn.
Lời giải:
Để so sánh được tính chất vật lí giữa các phân tử, chúng ta cần nắm được những ý sau:
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.


