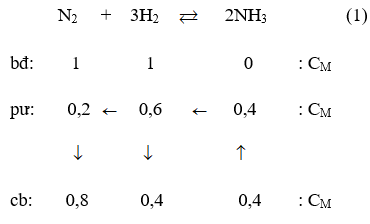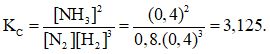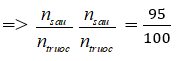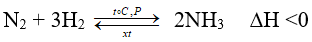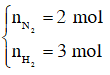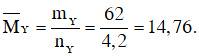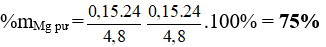Trắc nghiệm Hóa học 11 Bài 7 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 11 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 11
Trắc nghiệm Hóa học 11 Bài 7: Nitơ
Bài 1: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1.278
B. 3,125
C. 4.125
D. 6,75
Đáp án: B
Theo giả thiết ta thấy ban đầu [H2] = [N2] = 1M.
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng [NH3] = 0,4M
Phương trình phản ứng hoá học :
Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] = 0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
Bài 2: Hỗn hợp N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5% so với áp suất ban đầu. biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là
A. 20%.
B. 25%.
C. 10%.
D. 5%.
Đáp án: D
N2 + 3H2 -toC→ 2NH3
Áp suất thay đổi 5% so với áp suất ban đầu
Giả sử trước phản ứng có 1 mol ⇒ sau phản ứng có 0,95 mol
ntrước – nsau = 2nN2 pư = 0,05 mol
nN2 ban đầu = 0,025 : 10% = 0,25 ⇒ %nN2 = 25%
Bài 3: Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn sô với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
A. 10%.
B. 20%.
C. 25%.
D. 5%.
Đáp án: C
MX = 4.1,8 = 7,2
Xét 1 mol hỗn hợp gồm a mol N2 và b mol H2:
a + b = 1; 28a + 2b = 7,2 ⇒ a = 0,2; b = 0,8 (mol)
N2 + 3H2 → 2NH3
nY = 1 – 2a
Mà MY = 4.2 = 8; mY = mX = 7,2 ⇒ nY = 0,9 = 1 – 2a
⇒ a = 0,05 (mol). Vậy H = (0,05/0,2). 100% = 25%
Bài 4: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng
Đáp án: A
Bài 5: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
Chiều thuận của phản ứng có tổng số mol khí giảm ⇒ muốn tăng hiệu suất thì tăng áp suất
Chiều thuận của phản ứng là chiều tỏa nhiệt ⇒ tăng hiệu suất thì giảm nhiệt độ

Bài 6: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. nhiệt phân NaNO2
B. Đun hỗn hợp NaNO2 và NH4Cl
C. thủy phân Mg3N2
D. phân hủy khí NH3
Đáp án: B
Bài 7: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 → 2NH3
B. N2 + 6Li → 2Li3N
C. N2 + O2 → 2NO
D. N2 + 3Mg → Mg3N2
Đáp án: C
Bài 8: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Bài 9: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
A. 15,12
B. 18,23
C. 14,76
D. 13,48
Đáp án: C
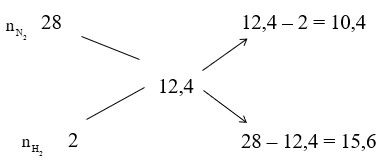
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên: nY = nX - 0,8 = 2 + 3 - 0,8 = 4,2 mol
Theo định luật bảo toàn khối lượng ta có: mY = mX = mN2 + mH2 = 2.28 + 3.2 = 62 gam
Vậy
Bài 10: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Đáp án: D
Trong bình phản ứng cùng thể tích nhiệt độ do đó áp suất tỉ lệ với số mol, áp suất bình giảm 5% so với ban đầu ⇒ nN2 pư = 5% ban đầu = 0,05 mol
3Mg + N2 -toC→ Mg3N2
nMg = 3nN2 = 0,15
Bài 12: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với ôxi tạo ra hợp chất X. Công thức của X là
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Đáp án: C
Bài 13: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây ?
A. H2.
B. O2.
C. Mg.
D. Al.
Đáp án: B
Bài 14: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Đáp án: A
Bài 15: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kemms hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Đáp án: A