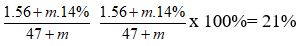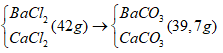Trắc nghiệm Hóa học 11 Bài 4 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 11 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 11
Trắc nghiệm Hóa học 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài 1: Dung dịch X có chứa 0,07 mol Na+, 0,02 mol SO42-, và x mol OH-. Dung dịch Y có chứa ClO4-, NO3- và y mol H+; tổng số mol ClO4-, NO3- là 0,04 mol. Trộn X và T được 100 ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của H2O) là :
A. 1.
B. 12.
C. 13.
D. 2.
Đáp án: A
Áp dụng bảo toàn điện tích cho các dung dịch X và Y ta có:
1.nNa+ = 2.nSO42- + 1.nOH- ⇒ 0,07 = 0,02.2 + x ⇒ x = 0,03
1.nClO4- + 1.nNO3- = 1.nH+ ⇒ y = 0,04
Phương trình phản ứng:
H+ + OH- → H2O
⇒ nH+ dư = 0,01 ⇒ [H+] = 0,1 ⇒ pH = 1
Bài 2: Cho 47 gam K2O vào m gam dung dịch KOH 14%, thu được dung dịch KOH 21%. Giá trị của m là
A. 353.
B. 659.
C. 753.
D. 800.
Đáp án: B
nK2O = 0,5 mol ⇒ nKOH tạo ra = 1 mol;
Dung dịch KOH 21% ⇒
⇒ m = 659 gam
Bài 3: Để pha được 1 lít dung dịch chứa Na2SO4 0,04M, K2SO4 0,05 M và KNO3 0,08M cần lấy
A. 12,15 gam K2SO4 và 10,2 gam NaNO3.
B. 8,08 gam KNO3 và 12,78 gam Na2SO4.
C. 15,66 gam K2SO4 và 6,8 gam NaNO3.
D. 9,09 gam KNO3 và 5,68 gam Na2SO4.
Đáp án: C
Trong 1 lít dung dịch cần pha có:
nNa+ = 0,08 mol, nK+ = 0,18 mol, nSO42- = 0,09 mol, nNO3- = 0,08 mol
⇒ Ban đầu có 0,08 mol NaNO3 và 0,09 mol K2SO4
⇒ Cần phải thêm lấy 6,8 gam NaNO3 và 15,66 gam K2SO4
Bài 4: Hòa tan một hỗn hợp 7,2 gam gồm hai muối sunfat của kim loại A và B vào nước được dung dịch X. Thêm vào dung dịch X môt lượng vừa đủ BaCl2 đã kết tủa ion SO42-, thu được 11,65 gam BaSO4 và dung dịch Y. Tổng khối lượng hai muối clorua trong dung dịch Y là
A. 5,95 gam.
B. 6,5 gam.
C. 7,0 gam.
D. 8,2 gam.
Đáp án: A
M2(SO4)n + nBaCl2 → 2MCln + nBaSO4
⇒ nBaSO4 = 0,05 mol = nBaCl2
Theo bảo toàn khối lượng: mM2(SO4)n + mBaCl2 = mMCln + mBaSO4
⇒ mMCln = 5,95g
Bài 5: Cho 1 lít dung dịch gồm Na2CO3 0,1M và (NH4)2CO3 0,25M tác dụng với 43 gam hỗn hợp rắn Y gồm BaCl2 và CaCl2. Sau khi phản ứng kết thúc, thu được 39,7 gam kết tủa. Tỉ lệ khối lượng của BaCl2 trong Y là
A. 24,19%.
B. 51,63%.
C. 75,81%.
D. 48,37%
Đáp án: D
nBaCl2 = x mol; nCaCl2 = y mol
Y:
mgiảm = 42 - 39,7 = mCl- - mCO32-
⇒ 71(x + y) – 60(x + y) = 3,3 gam
x + y = 0,3 mol (1)
mkết tủa = 39,7 ⇒ 197x + 100y = 39,7 (2)
Từ (1)(2) ⇒ x = 0,1; y = 0,2
%m BaCl2 = [(208. 0,1)/43]. 100% = 48,37%

Bài 6: Cho dung dịch Fe2(SO4)3 phản ứng với dung dịch Na2CO3 thì sản phẩm tạo ra là:
A. Fe2(CO3)3 và Na2SO4
B. Na2SO4; CO2 và Fe(OH)3
C. Fe2O3; CO2; Na2SO4 và CO2
D. Fe(OH)3; CO2; Na2SO4; CO2
Đáp án: B
Fe2(SO4)3 + 3Na2CO3 → Fe2(CO3)3 + 3Na2SO4
Tuy nhiên Fe2(CO3)3 không bền bị thủy phân:
Fe2(CO3)3 + 3H2O → 2Fe(OH)3 + 3CO2
→ Fe2(SO4)3 + 3Na2CO3 + H2O → 2Fe(OH)3 + 3CO2 + 3Na2SO4
Bài 7: Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Đáp án: C
Bài 8: Các ion nào sau không thể cùng tồn tại trong một dung dịch
A. Na+, Mg2+, NO3-, SO42-.
B. Ba2+, Al3+, Cl-, HSO4-.
C. Cu2+, Fe3+, SO42-, Cl-.
D. K+, NH4+, OH-, PO43-.
Đáp án: B
Bài 9: Các ion có thể tồn tại trong cùng một dung dịch là:
A. Na+, NH4+, SO42-, Cl-.
B. Mg2+, Al3+, NO3-, CO32-.
C. Ag+, Mg2+, NO3-, Br-.
D. Fe2+, Ag+, NO3-, CH3COO-.
Đáp án: A
Bài 10: Cho 26,8 gam hỗn hợp X gồm CaCO3 và MgCO3 vào dung dịch HCl vừa đủ, thoát ra 6,72 lít khí (đktc) và dung dịch Y chứa m gam muối clorua. Giá trị của m là
A. 30,1.
B. 31,7.
C. 69,4.
D. 64,0.
Đáp án: A
2H+ + CO32- → CO2 + H2O
nCl- = nH+ = 2nCO2 = 0,6 mol
m = mX – mCO32- + mCl- = 26,8 – 0,3.60 + 0,6.35,5 = 30,1 gam
Bài 11: Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3
A. KBr B. K3PO4
C. HCl D. H3PO4
Đáp án: D
Bài 12: Cho dung dịch chứa các ion sau : Na+ ,Ca2+ ,Mg2+ ,Ba2+ , H+ , NO3-. Muốn tách được nhiều cation ra khỏi dung dịch mà không đưa ion lạ vào dung dịch người ta dùng :
A. dung dịch K2CO3vừa đủ .
B. dung dịch Na2SO4 vừa đủ.
C. dung dịch KOH vừa đủ.
D. dung dịch Na2SO3 vừa đủ.
Đáp án: D
Bài 13: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch ?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Đáp án: C
Bài 14: Phản ứng hóa học nào sau đây có phương trình ion thu gọn là H+ + OH- → H2O ?
A. HCl + NaOH → H2O + NaCl
B. NaOH + NaHCO3 → H2O + Na2CO3
C. H2SO4 + BaCl2 → 2HCl + BaSO4
D. H2SO4 +Ba(OH)2 → 2 H2O + BaSO4
Đáp án: A
Bài 15: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau : Ba2+ ,Al3+ , Na+, Ag+ ,CO32 ,NO3- ,Cl- ,SO42- . Các dung dịch đó là :
A. BaCl2,Al2(SO4)3,Na2CO3,AgNO3.
B. Ba(NO3)2, Al2(SO4)3,Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3,Na2CO3,AgNO3.
D. Ba(NO3)2, Al2(SO4)3,NaCl, Ag2CO3.
Đáp án: A