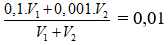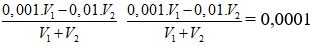Trắc nghiệm Hóa học 11 Bài 3 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 11 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 11 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 11
Trắc nghiệm Hóa học 11 Bài 3 : Sự điện li của nước. pH. Chất chỉ thị axit - bazơ
Bài 1: Cho các muối sau đây: NaNO3; K2CO3; CuSO4; FeCl3; AlCl3; KCl. Các dung dịch có pH = 7 là :
A. NaNO3; KCl.
B. K2CO3; CuSO4; KCl.
C. CuSO4; FeCl3; AlCl3.
D. NaNO3; K2CO3; CuSO4.
Đáp án: A
K2CO3: Bazơ
CuSO4, FeCl3, FeCl2: Axit
Bài 2: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là
A. 10 ml.
B. 15 ml.
C. 20 ml.
D. 25 ml.
Đáp án: C
H+ + OH- → H2O
Ta có: ⇒ V = 20 ml.
Bài 3: Dung dịch A có chứa 5 ion :Mg2+ ,Ba2+ ,Ca2+ và 0,1 mol Cl- và 0,2 mol NO3 . Thêm dần V ml dung dịch K2CO3 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
A. 150 ml.
B. 300 ml.
C. 200 ml.
D. 250 ml.
Đáp án: A
Khi thêm K2CO3 vào dung dịch A, khi lượng kết tủa thu được là lớn nhất tức là toàn bộ Mg2+, Ba2+, Ca2+ đã kết tủa, trong dung dịch còn lại KCl và KNO3
⇒ nK+ = nCl- + nNO3- = 0,3 mol
⇒ nK2CO3 = 0,15 mol
⇒ VK2CO3 = 150 ml
Bài 4: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch
Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330
B. 0,10 và 6,990.
C.0,10 và 4,660
D. 0.05 và 3,495
Đáp án: D
Sau phản ứng trung hòa pH = 1 ⇒ H+ dư
H+ + OH- → H2O
nH+bd = 0,08 mol; sau phản ứng pH = 1
⇒ nH+ sau p/ư = 0,05 mol
nH+p/ư = nOH- = 0,03 mol
⇒ nBa(OH)2 = 0,015 mol
⇒ CM Ba(HCO3)2 = 0,05 (mol/l)
nBaSO4 = nBa(OH)2 = 0,015 mol (H2SO4 dư) ⇒ mBaSO4 = 3,495
Bài 5: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134.
B. 147.
C. 114.
D. 169.
Đáp án: A
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1M 100 ml HNO3 0,2M và 100 ml HCl 0,3M trộn lại với nhau. Vậy:
Phản ứng của dung dịch A và B là: H+ + OH- → H2O
nH+ p/ư = nOH- = 0,049.0,001V ⇒ nH+ p/ư = 0,01 (0,3 + 0,001V)
⇒ 0,07 = 0,49.0,001V + 0,010,3 + 0,001V) ⇒ V = 134 ml

Bài 6: Dung dịch có pH = 7 là:
A. NH4Cl.
B. CH3COONa.
C. C6H5ONa.
D. KClO3.
Đáp án: D
Bài 7: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. NaCl.
B. NH4Cl.
C. Na2CO3.
D. FeCl3.
Đáp án: C
Bài 8: Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng) ?
A. CH3COOH, HCl và BaCl2.
B. NaOH, Na2CO3 và Na2SO3.
C. H2SO4, NaHCO3 và AlCl3.
D. NaHSO4, HCl và AlCl3.
Đáp án: D
Bài 9: Cho các dung dịch muối: Na2CO3 (1), NaNO3 (2), NaNO2 (3), NaCl (4), Na2SO4 (5), CH3COONa (6), NH4HSO4 (7), Na2S (8). Những dung dịch muối làm quỳ hoá xanh là :
A. (1), (2), (3), (4).
B. (1), (3), (5), (6).
C. (1), (3), (6), (8).
D. (2), (5), (6), (7).
Đáp án: C
(2) (4) (5): trung tính
(7): axit
Bài 10: Chọn câu trả lời đúng, khi nói về muối axit :
A. Dung dịch muối có pH < 7.
B. Muối cố khả năng phản ứng với bazơ.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối mà gốc axit vẫn còn hiđro có khả năng phân li tạo proton trong nước.
Đáp án: D
Bài 11:Trộn V1 ml dung dịch NaOH có pH = 13 với V2 ml dung dịch Ba(OH)2 có pH = 11, thu được dung dịch mới có pH = 12. Tỉ số V1 : V2 có giá trị là
A. 1/1
B. 2/1
C. 1/10
D. 10/1
Đáp án: C
Ban đầu nOH- = 0,1. V1 + 0,002. V2
pH = 12 ⇒
⇒ V1 : V2 = 1/10
Bài 12: Trộn V1 lít dung dịch H2SO4 có pH = 3 với 2 lít dung dịch NaOH có pH = 12, thu được dung dịch mới cố pH = 4. Tỉ số V1 : V2 có giá trị là
A. 8/1 B. 101/9 C. 10/1 D. 4/1
Đáp án: B
Ban đầu nH+ = 0,001.V1; nOH- = 0,01.V2
Dung dịch sau có: pH = 4 ⇒
⇒ V1 : V2 = 101/9
Bài 13: Trộn hai dung dịch Ba(HCO3)2 và NaHSO4 có cùng nồng độ mol với nhau theo tỉ lệ thể tích 1 : 1 thu được kết tủa và dung dịch và dung dịch . Bỏ qua sự thủy phân của các ion và sự điện li của nước, các ion cos mặt trong dung dịch Y là
A. Na+ và SO42-
B. Ba2+ ,HCO32- và Na+
C. Na+ , HCO32-
D. Na+ , HCO32- và SO42-
Đáp án: C
Bài 14: Cho các dung dịch HCl, H2SO4 và CH3COOH có cùng giá trị pH. Sự sqps xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên ?
A. HCl < H2SO4 < CH3COOH
B. H2SO4 < HCl < CH3COOH
C. H2SO4 < CH3COOH < HCl
D. CH3COOH < HCl < H2SO4
Đáp án: B
Bài 15: Chỉ dùng quỳ tím , có thể nhận biết ba dung dịch riêng biệt nào sau đây ?
A. HCl, NaNO3, Ba(OH)2 B. H2SO4, HCl,KOH.
C. H2SO4, NaOH, KOH D. Ba(OH)2, NaCl, H2SO4
Đáp án: A