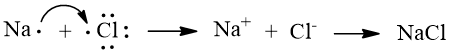Giải Hóa học 10 Kết nối tri thức Bài 21: Nhóm halogen
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim.
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh hoạ.
Lời giải:
Sự hình thành liên kết trong phân tử NaCl
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ tạo thành hạt mang điện dương, có cấu hình electron bền vững, giống với khí hiếm.
Viết gọn: Na → Na+ + 1e
Nguyên tử chlorine có 7 electron ở lớp ngoài cùng nhận 1 electron từ nguyên tử sodium. Khi nhận vào 1 electron nguyên tử chlorine sẽ tạo thành hạt mang điện âm, có cấu hình electron bền vững giống khí hiếm.
Viết gọn: Cl + 1e → Cl-
Các ion tạo thành Na+; Cl- có điện tích trái dấu hút nhau tạo nên phân tử NaCl.
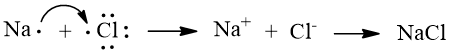
Sự hình thành liên kết trong phân tử HCl
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình electron bền vững của nguyên tử khí hiếm He) và nguyên tử chlorine có 8 electron lớp ngoài cùng, thoả mãn quy tắc octet.
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Kết nối tri thức hay, chi tiết khác:
Mở đầu trang 104 Hóa học 10: Trong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn sao tại ở cả dạng đơn chất...
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên, câu hỏi 1 trang 105...
Hoạt động 1 trang 105 Hóa học 10: Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả...
Hoạt động 2 trang 105 Hóa học 10: Dựa vào bán kính nguyên tử (Hình 6.2), hãy dự đoán xu hướng biến đổi độ dài liên kết...
Hoạt động 1 trang 106 Hóa học 10: Xác định số oxi hoá của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3...
Hoạt động 2 trang 106 Hóa học 10: Từ các số oxi hoá của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa...
Câu hỏi 2 trang 106 Hóa học 10: Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế...
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các halogen...
Câu hỏi 5 trang 108 Hóa học 10: Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine...
Hoạt động trang 108 Hóa học 10: Dựa vào số liệu năng lượng liên kết H – X, giải thích xu hướng phản ứng giảm dần...
Câu hỏi 6 trang 109 Hóa học 10: Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt...
Hoạt động trang 109 Hóa học 10: Đính một mẩu giấy màu ẩm vào dây kim loại gắn với nút đậy bình tam giác...
Câu hỏi 7 trang 110 Hóa học 10: Khí Cl2 phản ứng với dung dịch sodium hydroxide nóng tạo thành sodium chloride...
Hoạt động trang 110 Hóa học 10: Viết phương trình hoá học minh hoạ tính oxi hoá giảm dần trong dãy Cl2, Br2, I2...
Câu hỏi 8 trang 110 Hóa học 10: Phản ứng thế của một số muối halide Chuẩn bị: 3 ống nghiệm, dung dịch NaBr...
Câu hỏi 9 trang 111 Hóa học 10: Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm...