Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép
Lời giải câu hỏi 8 trang 25 Hóa học 10 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Kết nối tri thức Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Câu hỏi 8 trang 25 Hóa học 10: Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Lời giải:
Ta có: Z = 14 ⇒ Nguyên tử silicon có 14 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền cho đến electron cuối cùng
1s22s22p63s23p2.
⇒ Cấu hình electron của nguyên tử silicon có Z = 14: 1s22s22p63s23p2, được biểu diễn theo ô orbital là:
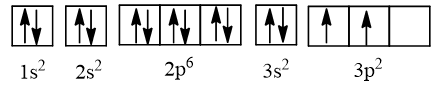
Lưu ý:
- Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s ...
- Nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
- Quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Kết nối tri thức hay, chi tiết khác:


