Trong nguyên tử các electron chuyển động như thế nào? Sự sắp xếp các electron ở các lớp
Lời giải mở đầu trang 21 Hóa học 10 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Kết nối tri thức Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Mở đầu trang 21 Hóa học 10: Trong nguyên tử các electron chuyển động như thế nào? Sự sắp xếp các electron ở các lớp, các phân lớp tuân theo nguyên lí và quy tắc nào?
Lời giải:
- Theo mô hình hành tinh nguyên tử: Các electron chuyển động xung quanh hạt nhân nguyên tử theo những quỹ đạo tròn hay bầu dục, giống như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
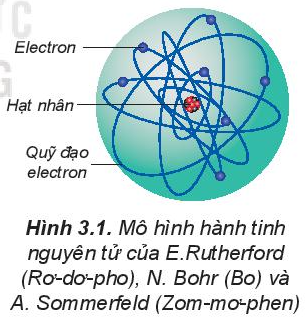
- Theo mô hình hiện đại: Trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Tuy nhiên, người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt (xác suất tìm thấy) electron là lớn nhất (khoảng 90%). Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là orbital nguyên tử (kí hiệu là AO).

- Cấu hình electron của nguyên tử và cách viết cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn tuần theo: nguyên tí vững bền, nguyên lí Pauli và quy tắc Hund.
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s ...
+ Nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
+ Quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Kết nối tri thức hay, chi tiết khác:


