Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt
Lời giải Bài 13.12 trang 39 SBT Hóa học 10 sách Cánh Diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải SBT Hóa học 10 Cánh Diều Bài 13: Phản ứng oxi hóa – khử
Bài 13.12 trang 39 SBT Hóa học 10: Trong công nghiệp, sulfuric acid được sản xuất từ quặng pirite sắt có thành phần chính là FeS2, theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4
a) Hoàn thành sơ đồ trên bằng các phương trình hoá học, cân bằng các phương trình hoá học đó. Trong sơ đồ trên, những phản ứng nào là phản ứng oxi hoá - khử? Chỉ rõ chất khử và chất oxi hoá của mỗi phản ứng đó.
b) Tính khối lượng H2SO4 98% điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết hiệu suất cả quá trình là 80%.
c) Đề xuất một công thức cấu tạo phù hợp cho FeS2, biết S có số oxi hoá -1 trong chất này.
Lời giải:
a) Hoàn thành các phương trình hóa học:
1)
Phương trình hóa học:
4FeS2 + 11O2 2Fe2O3 + 8SO2
Trong phản ứng oxi hóa – khử này FeS2 là chất khử, O2 là chất oxi hóa.
2/
Phương trình hóa học:
2SO2 + O2 2SO3
Trong phản ứng oxi hóa – khử này SO2 là chất khử, O2 là chất oxi hóa.
3/ SO3 + H2O → H2SO4
Phản ứng này không phải là phản ứng oxi hóa - khử.
b) 1 tấn quặng chứa 60% FeS2 (M = 120 g mol-1)
Số mol FeS2 trong 1 tấn quặng trên là: 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
tấn.
c) Trong FeS2 nguyên tố S có số oxi hóa -1, đề xuất công thức cấu tạo là:
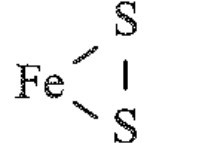
Xem thêm các bài giải sách bài tập Hóa học 10 bộ sách Cánh Diều hay, chi tiết khác:
Bài 13.1 trang 37 SBT Hóa học 10: Phát biểu nào sau đây là đúng?...
Bài 13.2 trang 37 SBT Hóa học 10: Phát biểu nào sau đây không đúng?...
Bài 13.3 trang 37 SBT Hóa học 10: Số oxi hoá của chromium (Cr) trong Na2CrO4 là ...
Bài 13.4 trang 37 SBT Hóa học 10: Số oxi hoá của carbon và oxygen trong C2O42- lần lượt là:...
Bài 13.6 trang 37 SBT Hóa học 10: a) Xác định số oxi hoá của mỗi nguyên tử trong các chất hoá học hoặc các ion sau: NO3-; H2PO4-; CaHAsO4; Mg2TiO4...
Bài 13.9 trang 38 SBT Hóa học 10: Những phát biểu nào sau đây đúng?...
Bài 13.10 trang 39 SBT Hóa học 10: Những phát biểu nào sau đây không đúng?...
Bài 13.11 trang 39 SBT Hóa học 10: Điền vào chỗ trống trong đoạn thông tin sau:...
Bài 13.17* trang 40 SBT Hóa học 10: Sự cháy của hydrocarbon trong oxygen:...
Xem thêm lời giải sách bài tập Hóa học lớp 10 Cánh diều với cuộc sống hay, chi tiết khác:
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Bài 16: Tốc độ phản ứng hóa học


