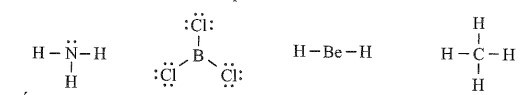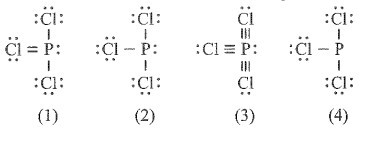Sách bài tập Hóa học 10 Bài 11 Cánh diều: Liên kết cộng hóa trị
Với giải sách bài tập Hóa học 10 Bài 11: Liên kết cộng hóa trị sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 11.
Giải sách bài tập Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị - Cánh diều
A. 1s.
B. 2s.
C. 2s, 2p.
D. ls, 2s, 2p.
Lời giải:
Đáp án đúng là: C
Cấu hình electron của carbon (C): 1s22s22p2.
Trong nguyên tử C, electron có khả năng tham gia hình thành liên kết cộng hóa trị là các electron ở lớp ngoài cùng hay là các electron ở phân lớp 2s; 2p.
Bài 11.2 trang 30 SBT Hóa học 10:Những phát biểu nào sau đây là không đúng?
A. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ bền vững hơn.
B. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
C. Các nguyên tử liên kết với nhau theo xu hướng tạo lớp vỏ electron được octet.
D. Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng cao hơn.
E. Các nguyên tử nguyên tố phi kim chỉ liên kết với các nguyên tử nguyên tố kim loại.
Lời giải:
Đáp án đúng là: D và E
Phát biểu D sai vì các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
Phát biểu E sai vì các nguyên tử nguyên tố phi kim có thể liên kết với các nguyên tử nguyên tố kim loại hoặc nguyên tử nguyên tố phi kim.
Bài 11.3 trang 30 SBT Hóa học 10: Liên kết cộng hoá trị thường được hình thành giữa
A. các nguyên tử nguyên tố kim loại với nhau.
B. các nguyên tử nguyên tố phi kim với nhau.
C. các nguyên tử nguyên tố kim loại với các nguyên tử nguyên tố phi kim.
D. các nguyên tử khí hiếm với nhau.
Lời giải:
Đáp án đúng là: B
Liên kết cộng hoá trị thường được hình thành giữa các nguyên tử nguyên tố phi kim với nhau.
A. 1, 2, 3, 4.
B. 1, 2, 3, 1.
C. 2, 2, 2, 2.
D. 1, 2, 2, 1.
Lời giải:
Đáp án đúng là: B
+ Nguyên tử H có 1 electron ở lớp ngoài cùng, mỗi nguyên tử H có xu hướng góp chung 1 electron để tạo thành phân tử H2. Công thức cấu tạo: H – H.
+ Nguyên tử O có 6 electron ở lớp ngoài cùng, mỗi nguyên tử O có xu hướng góp chung 2 electron để tạo thành phân tử O2. Công thức cấu tạo: O = O.
+ Nguyên tử N có 5 electron ở lớp ngoài cùng, mỗi nguyên tử N có xu hướng góp chung 3 electron để tạo thành phân tử N2. Công thức cấu tạo: N ≡ N.
+ Nguyên tử F có 7 electron ở lớp ngoài cùng, mỗi nguyên tử F có xu hướng góp chung 1 electron để tạo thành phân tử F2. Công thức cấu tạo: F – F.
Số lượng cặp electron dùng chung trong các phân tử H2, O2, N2, F2 lần lượt là: 1, 2, 3, 1.
A. 1 và 3.
B. 2 và 2.
C. 3 và 1.
D.1 và 4.
Lời giải:
Đáp án đúng là: A
Công thức Lewis của HF là:
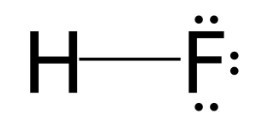
Vậy số cặp electron dùng chung là 1; cặp electron hóa trị riêng của F là 3.
Bài 11.6 trang 30 SBT Hóa học 10: Cho công thức Lewis của các phân tử sau:
Số phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Các phân tử BCl3 và BeH2 có nguyên tử trung tâm không thỏa mãn quy tắc octet.
Ở BCl3, nguyên tử B mới có 6 electron ở lớp ngoài cùng.
Ở BeH2, nguyên tử Be mới có 4 electron ở lớp ngoài cùng.
Bài 11.7 trang 31 SBT Hóa học 10:Công thức nào sau đây ứng với công thức Lewis của phân tử PCl3?
A. Công thức (1).
B. Công thức (2).
C. Công thức (3).
D. Công thức (4).
E. Công thức (2) và (4).
Lời giải:
Đáp án đúng là: B
Công thức (1) và (3) sai vì mỗi Cl chỉ góp chung 1 electron.
Công thức (4) sai vì P bị thiếu một cặp electron riêng.
A. HF.
B. HCI.
C. HBr.
D. HI.
Lời giải:
Đáp án đúng là: A
H có độ âm điện là 2,2.
Từ F đến I độ âm điện giảm dần, nên hiệu độ âm điện giữa H và F là lớn nhất, liên kết trong phân tử HF là phân cực nhất.
Lời giải:
Trong số các hợp chất: Cl2, H2O, O2, CsF, NaF, SO2, có (1) hai chất ion và (2) bốn chất cộng hoá trị. Trong điều kiện thường, (3) hai hợp chất tồn tại thể rắn là (4) CsF và (5) NaF; (6) một hợp chất tồn tại ở thể lỏng là (7) H2O, còn lại là các chất khí. Chất có nhiệt độ sôi, nhiệt độ nóng chảy cao nhất là (8) NaF. Trong số các chất cộng hoá trị, (9) H2O, (10) SO2 là các chất cộng hoá trị phân cực; (11) Cl2 và (12) O2 là các chất cộng hoá trị không phân cực.
|
1. Liên kết cộng hoá trị phân cực |
Lời giải:
+ a nối với 3, giải thích:
Do liên kết giữa Sr và F là liên kết giữa kim loại điển hình và phi kim điển hình nên là liên kết ion.
+ b nối với 2, giải thích:
Hiệu độ âm điện là 3,16 – 3,04 = 0,02 < 0,4 nên liên kết giữa N và Cl là liên kết cộng hoá trị không phân cực.
+ c nối với 1, giải thích:
Hiệu độ âm điện là 3,44 – 3,04 = 0,4 nên liên kết giữa N và O là liên kết cộng hoá trị phân cực.
A. Phân lớp 2s, hình cầu.
B. Phân lớp 2s, hình số tám nổi.
C. Phân lớp 2p, hình số tám nổi.
D. Phân lớp 2p, hình cánh hoa.
Lời giải:
Đáp án đúng là: C
Cấu hình electron của F: 1s22s22p5.
Khi tham gia hình thành liên kết trong các phân tử HF, F2; orbital tham gia xen phủ tạo liên kết của nguyên tử F thuộc về phân lớp 2p.
AO p có dạng số tám nổi.
A. 3.
B. 4.
C. 5.
D. 6.
Lời giải:
Đáp án đúng là: D
Mỗi nguyên tử sử dụng 3AO 2p, mỗi AO chứa 1 electron độc thân để tham gia xen phủ tạo thành 3 liên kết.
Số orbital của cả hai nguyên tử N tham gia xen phủ tạo liên kết trong phân tử N2 là 6.
A. Cl2.
B. H2.
C. NH3.
D. Br2.
Lời giải:
Đáp án đúng là: C
Liên kết trong phân tử NH3 được hình thành do AO s (của H) xen phủ với AO p (của N).
Bài 11.14 trang 32 SBT Hóa học 10: Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B. Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết σ.
C. Liên kết σ bền vững hơn liên kết π.
D. Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
Lời giải:
Đáp án đúng là: A
A không đúng do vẫn có thể có AO s xen phủ với AO p.
A. 1, 2 và 3.
B. 2, 4 và 6.
C. 1, 3 và 5.
D. 2, 3 và 4.
Lời giải:
Đáp án đúng là: B
Mỗi liên kết được hình thành do sự dùng chung 1 cặp (tức 2 electron). Vậy:
+ Liên kết đơn được hình thành từ 2 electron.
+ Liên kết đôi được hình thành từ 4 electron.
+ Liên kết ba được hình thành từ 6 electron.
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(2) Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(4) Là khí trơ.
(5) Có hai cặp electron hoá trị riêng.
(6) Liên kết trong phân tử là liên kết đơn.
Lời giải:
- N2, công thức Liwis:
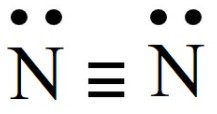
Các nhận định thỏa mãn:
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(5) Có hai cặp electron hoá trị riêng.
- Ar, nhận định thỏa mãn:
(4) Là khí trơ.
- CO, công thức Lewis:
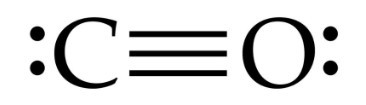
Các nhận định thỏa mãn:
(2) Liên kết trong phân tử là liên kết cộng hoá trị phân cực.
(3) Các nguyên tử trong phân tử đều tuân theo quy tắc octet.
(5) Có hai cặp electron hoá trị riêng.
- H2, công thức cấu tạo: H – H, các nhận định thỏa mãn:
(1) Liên kết trong phân tử là liên kết cộng hoá trị không phân cực.
(6) Liên kết trong phân tử là liên kết đơn.
Bài 11.17 trang 32 SBT Hóa học 10: Xét phân tử H2O, những phát biểu nào sau đây là đúng?
A. Liên kết H – O là liên kết cộng hoá trị không phân cực.
B. Liên kết H – O là liên kết cộng hoá trị phân cực.
C. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử O.
D. Cặp electron dùng chung trong liên kết H – O lệch về phía nguyên tử H.
E. Cặp electron dùng chung trong liên kết H – O phân bố đều giữa hai nguyên tử.
G. Nguyên tử O còn hai cặp electron hoá trị riêng.
Lời giải:
Đáp án đúng là: B, C, G.
- Liên kết H – O trong phân tử nước là liên kết cộng hóa trị phân cực, cặp electron chung bị lệch về phía nguyên tử có độ âm điện cao hơn là O.
- Công thức Lewis của H2O là:
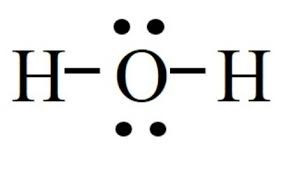
Vậy nguyên tử O còn hai cặp electron hóa trị riêng.
Bài 11.18 trang 32 SBT Hóa học 10:Xét phân tử CO2, những phát biểu nào sau đây là không đúng?
A. Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị không phân cực.
B. Liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị phân cực.
C. Phân tử CO2 có 4 electron hoá trị riêng.
D. Phân tử CO2 có 4 cặp electron hoá trị riêng.
E. Trong phân tử CO2 có 3 liên kết σ và 1 liên kết π.
G. Trong phân tử CO2 có 2 liên kết σ và 2 liên kết π.
H. Trong phân tử CO2 có 1 liên kết σ và 3 liên kết π.
Lời giải:
Đáp án đúng là: A, C, E, H.
Công thức Lewis của CO2 là:
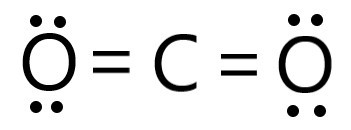
Phát biểu A sai do liên kết giữa hai nguyên tử C và O là liên kết cộng hoá trị phân cực.
Phát biểu C sai vì phân tử CO2 có 4 cặp electron hoá trị riêng.
Phát biểu E, H sai vì trong phân tử CO2 có 2 liên kết σ và 2 liên kết π.
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: D
Công thức cấu tạo của NH4+ là:
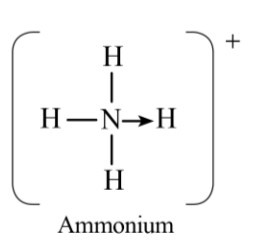
Hóa trị của N trong NH4+ là 4.
A. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Liên kết H – Br là bền vững hơn so với liên kết H – I.
C. Khi đun nóng, HI bị phân hủy (thành H2 và I2) ở nhiệt độ cao hơn so với HBr (thành H2 và Br2).
D. Liên kết H – I là bền vững hơn so với liên kết H – Br.
Lời giải:
Đáp án đúng là: C và D.
Chú ý: Năng lượng liên kết càng thấp, liên kết càng kém bền và càng dễ bị phá vỡ.
Lời giải:
1 mol H2 chứa 6,02 × 1023 phân tử H2.
436 kJ = 436 × 103 J.
Năng lượng cần thiết để phá vỡ liên kết trong một phân tử H2 là:
Năng lượng cần thiết (theo eV) để phá vỡ liên kết trong một phân tử H2 là:
Lời giải:
Công thức Lewis của các phân tử H2O, NH3 và CH4:
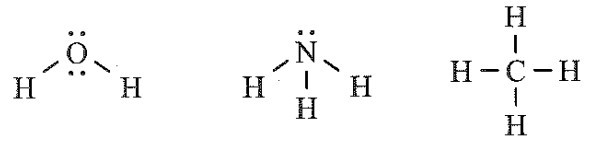
Số cặp electron riêng của H2O, NH3 và CH4 lần lượt là: 2, 1 và 0.
a) Tính tổng năng lượng liên kết trong mỗi phân tử H2S và H2O.
Lời giải:
a) Tổng năng lượng liên kết là 2EH – X với X là S, O.
Tổng năng lượng liên kết trong phân tử H2S là: 2 × 368 = 736 (kJ mol-1)
Tổng năng lượng liên kết trong phân tử H2O là: 2 × 464 = 928 (kJ mol-1)
b) Nhiệt độ bắt đầu phân hủy của H2O cao hơn do liên kết H – O bền hơn liên kết H – S.
Lời giải:
Năng lượng liên kết F – F là 159 kJ mol-1, năng lượng liên kết N ≡ N là 946 kJ mol-1 nên phân tử F2 sẽ dễ tham gia phản ứng với H2 hơn so với N2 do liên kết F – F dễ bị phá vỡ hơn.
Lời giải:
Bản chất liên kết ion trong NaCl là lực hút tĩnh điện giữa các ion mang điện tích trái dấu, không có tính định hướng.
Do vậy, một ion Na+ có thể hút nhiều ion Cl- xung quanh nó và ngược lại, dẫn tới ở điều kiện thường trong tinh thể NaCl, một ion được bao quanh bởi nhiều ion trái dấu thay vì phân tử NaCl chỉ có 2 ion.