Sách bài tập Hóa học 10 Bài 15 Cánh diều: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Với giải sách bài tập Hóa học 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 15.
Giải sách bài tập Hóa học lớp 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học - Cánh diều
Bài 15.1 trang 44 SBT Hóa học 10: Nối mỗi nội dung ở cột A với nội dung ở cột B sao cho phù hợp:
Lời giải:
- a ghép với 4:
Trong phản ứng thu nhiệt, dấu của ∆H dương vì năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
- b ghép với 1:
Trong phản ứng tỏa nhiệt có sự giải phóng năng lượng.
- c ghép với 3:
Trong phản ứng tỏa nhiệt, ∆H có dấu âm vì năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm.
- d ghép với 2:
Trong phản ứng thu nhiệt có sự giải phóng năng lượng.
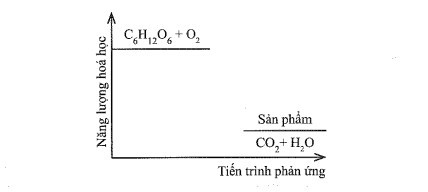
a) Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao?
b) Viết phương trình hoá học của phản ứng thuỷ phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hoá - khử không? Nếu có, hãy chỉ ra chất oxi hoá và chất khử trong phản ứng và cân bằng phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
c) Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn toả ra một lượng nhiệt là 5 645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hoá sucrose.
d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu?
e) Vì sao để duy trì một cơ thể khoẻ mạnh, cần một chế độ dinh dưỡng đầy đủ và luyện tập thể dục thể thao hợp lí?
Lời giải:
a) Phản ứng này là tỏa nhiệt vì có biến thiên enthalpy âm (năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm).
b) Phản ứng thuỷ phân đường sucrose trong môi trường acid và đun nóng:
C12H22O11 + H2O C6H12O6 (glucose) + C6H12O6 (fructose)
Phản ứng trong sơ đồ là phản ứng oxi hóa – khử; trong đó oxygen là chất oxi hóa; đường glucose và fructose là chất khử.
Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron:
Các quá trình:
Phương trình hóa học:
C6H12O6(g) + 6O2(g) → 6CO2(g) + 6H2O(l)
c) Phản ứng đốt cháy đường sucrose:
C12H22O11(s) + 12O2(g) → 12CO2(g) + 11H2O(l)
Biến thiên enthalpy chuẩn của phản ứng là:
d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng:
e) Cơ thể cần năng lượng để hoạt động nên phải có chế độ dinh dưỡng đầy đủ.
Luyện tập thể dục thể thao hợp lý là một phần quan trọng của lối sống lành mạnh. Tập thể dục thể thao giúp hạn chế các vấn đề sức khỏe, giúp cơ thể khỏe mạnh, cung cấp năng lượng, giúp giảm căng thẳng. Bên cạnh đó, còn có thể giúp bạn duy trì một trọng lượng cơ thể hợp lý và kiểm soát sự thèm ăn của bạn.
a) Quá trình tan chảy của nước đá là quá trình thu nhiệt hay toả nhiệt? Vì sao?
b) Vì sao khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá lại tan chảy dần?
c) Vì sao cốc nước lỏng bị lạnh dần trong quá trình viên nước đá tan chảy?
(Trong phần d, e, giả thiết chỉ có sự trao đổi nhiệt giữa nước và nước đá.)
Lời giải:
a) Quá trình tan chảy của nước đá là quá trình thu nhiệt vì có biến thiên enthalpy dương.
b) Khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá tan chảy dần vì nó lấy nhiệt từ nước lỏng (là môi trường xung quanh).
c) Nước lỏng nhường nhiệt cho viên nước đá, sự mất nhiệt làm cho nước lỏng lạnh đi.
d) Nhiệt lượng mà 500 gam nước lỏng từ 20 oC giảm xuống 0 oC tỏa ra là:
Phần nhiệt lượng tỏa ra này được viên nước đá hấp thụ để tan chảy. Số viên nước đá tối thiểu cần là:
viên.
e) Nhiệt lượng tỏa ra khi nhiệt độ của 120 gam nước lỏng từ 45 oC giảm xuống 0 oC là:
Lượng nước đá cần dùng là:
Vậy dùng 150 gam nước đá là dư.
C2H5OH(l) + O2(g) → CO2(g) + H2O(l) (1)
a) Những nhận định nào sau đây là đúng?
(1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng.
(3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí.
(4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng.
A. (1), (2).
B. (1), (2), (3).
C. (1), (3), (4).
D. (3), (4).
E. (1).
G. (2), (3).
b) Biến thiên enthalpy chuẩn kèm theo quá trình khi 1 mol ethanol lỏng cháy hoàn toàn trong oxygen là , xác định enthalpy hình thành chuẩn của C2H5OH (lỏng).
(Những số liệu cần thiết được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
Lời giải:
a) Đáp án đúng là: G
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l) (1)
Phát biểu (1) sai vì để xét phản ứng tỏa nhiệt hay thu nhiệt cần dựa vào năng lượng hóa học của phản ứng.
Phát biểu (2) đúng, tổng hệ số cân bằng của phản ứng là 1 + 3 + 2 + 3 = 9.
Phát biểu (3) đúng.
Phát biểu (4) sai, sản phẩm của phản ứng chiếm một số mol lớn hơn so với chất phản ứng.
b) C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l)
Vậy
Những phát biểu nào sau đây là đúng?
A. Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ.
B. Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ mol-1.
C. Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia.
D. 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45 kJ năng lượng dưới dạng nhiệt.
E. 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969 × 105 J.
Lời giải:
Đáp án đúng là: B, C, D, E
A sai vì: Biến thiên enthalpy chuẩn của phản ứng là -296,9 kJ.
Bài 15.6 trang 46 SBT Hóa học 10: Phản ứng luyện gang trong lò cao có phương trình như sau:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g) (1)
A. 8,27 kJ.
B. 49,6 kJ.
C. 12,4 kJ.
D. 74,4 kJ.
(Các số liệu cần thiết tra trong Phụ lục 3, SGK Hóa học 10, Cánh Diều.)
Lời giải:
a)
Phương trình hóa học: Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Biến thiên enthalpy chuẩn của phản ứng:
b) Đáp án đúng là: A
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Theo phương trình hóa học ta có CO hết, Fe2O3 dư, tính toán theo mol CO.
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là
b) Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng trên thu nhiệt hay tỏa nhiệt?
c) Tính lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành.
d) Nếu muốn tạo ra được 1,0 kJ nhiệt lượng cần bao nhiêu gam Al phản ứng?
Lời giải:
a) Phương trình hóa học của phản ứng:
2Al(s) + 3Cl2(g) → 2AlCl3(g)
Đây là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của các nguyên tử trong phản ứng.
b) Biến thiên enthalpy chuẩn của phản ứng:
Phản ứng trên tỏa nhiệt.
c) Cứ 1 mol AlCl3 tạo thành giải phóng:
Lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành là:
d) Cứ 1 mol Al phản ứng giải phóng:
Nếu muốn tạo ra được 1,0 kJ nhiệt lượng cần khối lượng Al phản ứng là:
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
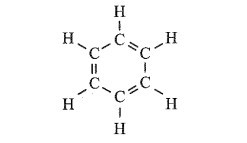
b) 6CH4 → C6H6 (1,3,5 – cyclohexatriene) + 9H2
Cho biết công thức cấu tạo của 1,3,5 – cyclohexatriene như sau:
Lời giải:
a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2
b) 6CH4 → C6H6 + 9H2
Các phản ứng này không thuận lợi về phương diện nhiệt.
Phản ứng theo chiều ngược lại thuận lợi về phương diện nhiệt:
CH2 = CH – CH = CH2 + 2H2 → H3C – CH2 – CH2 – CH3
C6H6 + 9H2 → 6CH4
H3C – CH2 – OH (g) → H3C – O – CH3 (g)
Lời giải:
CH3CH2OH có 1 liên kết C – C; 5 liên kết C – H; 1 liên kết C – O và 1 liên kết O – H.
CH3OCH3 có 6 liên kết C – H và 2 liên kết C – O.
Quá trình đã cho có biến thiên enthalpy chuẩn là:
chứng tỏ ở điều kiện chuẩn CH3CH2OH bền hơn CH3OCH3.
Bài 15.10 trang 47 SBT Hóa học 10: Xét các phản ứng thế trong dãy halogen ở điều kiện chuẩn:
(Các giá trị khác được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều).
Lời giải:
(1)
(2)
(3)
(4)
Hay còn viết:
(5)
Hay còn viết:
b) Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học.
Cụ thể, các giá trị biến thiên enthalpy chuẩn đều âm thể hiện quá trình diễn ra thuận lợi về phương diện nhiệt; quy luật tính chất oxi hóa của X: halogen có tính oxi hóa mạnh đẩy được halogen có tính oxi hóa yếu hơn ra khỏi muối của nó.
Hb + O2 → HbO2
Hb + CO → HbCO
HbO2 + CO → HbCO + O2
HbCO + O2 → HbO2 + CO
Liên hệ giữa mức độ thuận lợi của phản ứng (qua ) với những vấn đề thực nghiệm nêu trên.
Lời giải:
Vì các phản ứng (2) và (3) lần lượt có âm hơn phản ứng (1) và (4) nên sự hình thành HbCO thuận lợi hơn sự tạo thành HbO2. Do vậy không có sự nhả O2 và giải phóng Hb như trường hợp không có CO. Điều này giải thích sự ngộ độc CO trong máu.