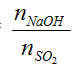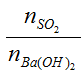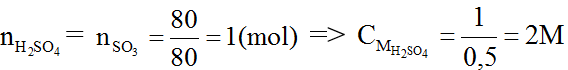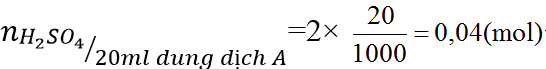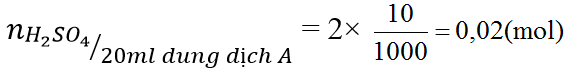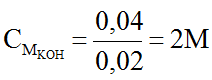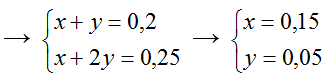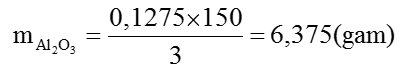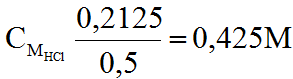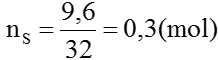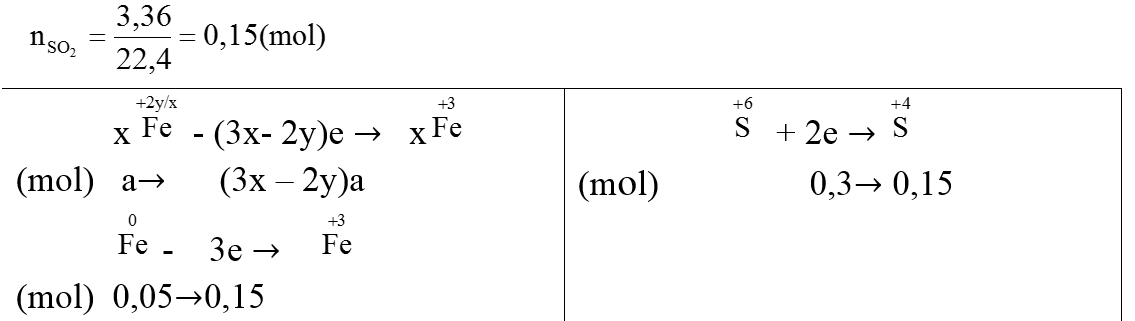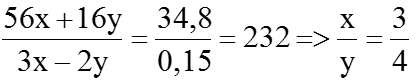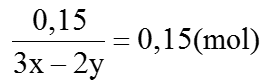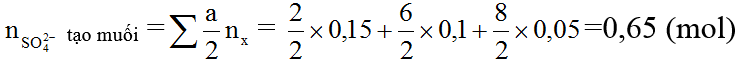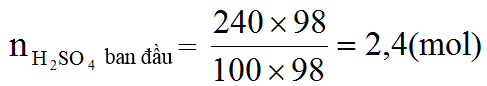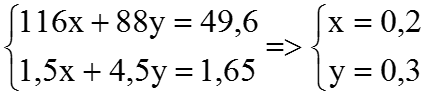Cách giải bài tập về hợp chất của lưu huỳnh hay, chi tiết
Cách giải bài tập về hợp chất của lưu huỳnh hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải bài tập về hợp chất của lưu huỳnh hay, chi tiết
Cách giải bài tập về hợp chất của lưu huỳnh hay, chi tiết
-
1. Bài tập về SO2, H2S, SO3 hoặc H2SO4 phản ứng với dung dịch kiềm
Bài toán 1: SO2 + NaOH hoặc KOH
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2 SO3 + H2 O (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối NaHSO3 (muối axit)
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối NaHSO3 và Na2 SO3
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Na2 SO3 (muối trung hòa)
Bài toán 2: SO2 + Ba(OH) 2 /Ca(OH) 2
SO2 + Ba(OH) 2 → BaSO3 ↓+ H2 O (1)
2SO2 + Ba(OH) 2 → Ba(HSO3) 2 (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối BaSO3 ↓
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối BaSO3↓ và Ba(HSO3)2
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Ba(HSO3) 2 (muối tan, không tạo kết tủa)
-
Ví dụ 1. Cho 80 gam SO3 vào một cốc nước sau đó thêm nước vào đến vạch 0,5 lít thì dừng (gọi là dung dịch A).
a) Tính nồng độ mol/l của dung dịch A.
b) Cho 20 ml dung dịch A vào dung dịch BaCl2 dư. Hãy tính khối lượng kết tủa thu được.
c) Để trung hòa 20ml dung dịch KOH thì cần 10ml dung dịch A. Tính nồng độ mol/l của dung dịch KOH.
Hướng dẫn:
Ta có: nSO3 = 80/80 = 1
SO3 + H2O → H2SO4 (1)
(mol) 1 → 1
Từ (1) ⇒
Phản ứng:
H2SO4 + BaCl2 → BaSO4 ↓+ 2HCl (2)
(mol) 0,04 → 0,04
Ta có:
Từ (2) ⇒nBaSO4= 0,04(mol) ⇒ mBaSO4=0,04 × 233=9,32 (gam)
Ta có:
2KOH + H2SO4 → K2SO4 + 2H2O (3)
(mol) 0,04 ← 0,02
Từ (3) ⇒ nKOH = 0,04 (mol) ⇒
Ví dụ 2: Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M. Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn:
nSO2 =
= 0,2 mol
nNaOH = 0,25.1 = 0,25 mol
1 < T =
= 1,25 < ; 2
→ Tạo 2 muối NaHSO3 và Na2 SO3
PTHH:
SO2 + NaOH → NaHSO3
x mol → x mol x
SO2 + 2NaOH → Na2 SO3 + H2 O
y mol → 2y mol y
→ mNaHSO3sub> = 0,15. 104 = 15,6g
mNa2O3 = 0,05 . 126 = 6,3g
Nhận xét : Có thể nhẩm nhanh trắc nghiệm: số mol 2 muối = số mol SO2
n Na2O3 = nNaOH - nSO2 = 0,25 – 0,2 = 0,05 mol
n NaHSO3 = nSO2 - n Na2O3 = 0,2 – 0,05 = 0,15 mol
Ví dụ 3: Hấp thụ 6,72 lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH) 2 2M. Tính khối lượng muối thu được
Hướng dẫn:
NSO2 = 0,3 mol; nBa(OH)2 = 0,2 mol
1 < T =
= 1,5 < 2
→ tạo 2 muối
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
a mol → a mol a
Ba(OH) 2 + 2SO2 → Ba(HSO3)2
b mol → 2b b
→ mBaSO3 = 0,1 . 217 = 12,7g
mBa(HSO3)2 = 0,1.299 = 29,9g
Cách 2:
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
x mol → x mol → x mol
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
x mol → x mol
tạo kết tủa, khi dư SO2, kết tủa bị hòa tan, để hòa tan hết kết tủa nSO2 ít nhất = 2x= 2nBa(OH)2
Nếu lượng SO2 không đủ để hòa tan hết kết tủa, thì kết tủa chỉ bị tan một phần tức tồn tại 2 muối BaSO3 và Ba(HSO3) 2
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,2 → 0,2 0,2
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
0,1 ← (0,3-0,2) → 0,1
NBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
Cách 3: Nhẩm trắc nghiệm: để hòa tan hết kết tủa nSO2 = 2nBa(OH)2 , nếu lượng kết tủa chỉ bị tan một phần
NSO2 = 2nBa(OH)2 - nkết tủa (vì tỉ lệ số mol hòa tan kết tủa là 1:1)
→ nBaSO3còn lại = 2nBa(OH)2 - nSO2 = 2.0,2 – 0,3 = 0,1 mol
Số mol 2 muối = số mol Ba(OH) 2 → nBa(HSO3)2 = nBa(OH)2 - nBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
→ mBaSO3 = 0,1 . 217 = 12,7g
MBa(HSO3)2 = 0,1.299 = 29,9g
Ví dụ 4: Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
Hướng dẫn:
Trường hợp 1: Ba(OH) 2dư, SO2 hết , nSO2 = n BaSO3
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 ←0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH) 2hết, SO2dư nhưng không hòa tan hết kết tủa ( kế t tủa chỉ tan một phần)
a(OH) 2 + SO2 → BaSO3↓+ H2O
0,1 0,1 ←0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
(tính nhanh nSO2 = 2nBa(OH)2 - n↓ = 2. 0,3 – 0,1 = 0,5 mol)
Ví dụ 5: Dẫn khí SO2 qua 200 ml dung dịch Ba(OH) 2 aM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính a
Hướng dẫn:
Thêm NaOH lại thu thêm kết tủa, chứng tỏ trong dung dịch tồn tại muối Ba(HSO3) 2, mà vẫn có kết tủa
→ tồn tại 2 muối
n↓(1) = = 0,1 mol
n↓(2) = = 0,05 mol
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
0,05 ←0,05
Ba(HSO3) 2 + 2NaOH → BaSO3 ↓ + Na2SO3 + 2H2O
0,05 ←0,05
nBa(OH)2 = 0,1 + 0,05 = 0,15 mol → a = = 0,75M
Cách 2:
↓ = 0,1 + 0,05 = 0,15 mol
Ba(OH) 2 → BaSO3
0,15 ←0,15
→ a =
= 0,75M
Ví dụ 6. Trộn 200 ml dung dịch NaOH 1M với 150ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
Hướng dẫn:
Ta có: nNaOH =0,2 × 1=0,2(mol); nH2SO4= 0,15 mol
Phản ứng: NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,15← 0,15 → 0,15
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,05 → 0,05
⇒ nNaHSO4dư = 0,15 – 0,05 =0,1 (mol)
⇒ mmuối = mNaHSO4 + mNa2SO4=120 ×0,1 + 142×0,05=19,1(gam)
-
-
Ví dụ 7: Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Hướng dẫn:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2NaOH → Na2 SO3 + H2 O
0,15 → 0,3
NSO2 = 0,15 mol , VNaOH = 200 ml = 0,2 lít
→ a = CM (NaOH)=
= 0,75M
-
2. Bài tập về S, H2S và muối sunfua
Chú ý:
- S phản ứng với kim loại tạo muối sunfua của kim loại với hóa trị thấp.
- Tính tan của muối sunfua trong nước và trong axit.

-
Ví dụ 2. Đun nóng một hỗn hợp bột gồm 2,97 gam Al và 4,08 gam S trong môi trường kín không có không khí, được sản phẩm là hỗn hợp rắn A. Ngâm A trong dung dịch HCl dư, thu được hỗn hợp khí B.
a) Hãy viết phương trình hóa học của các phản ứng.
b) Xác định thành phần định tính và khối lượng các chất trong hỗn hợp A.
c) Xác định thành phần định tính và thể tích các chất trong hỗn hợp khí B ở điều kiện tiêu chuẩn.
Hướng dẫn:
Phản ứng:
2Al + 3S → Al2S3 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
Al2S3 _+ 6HCl → 2AlCl3 + 3H2S (3)
Số mol Al=0,11 (mol); Số mol S=0,1275 (mol)
⇒ nAl dư =0,015 mol
Hỗn hợp A gồm Al dư và Al2S3
Vậy: mAl=0,025 × 27=0,675(gam)
Hỗn hợp khí B gồm H2 và H2S
VH2= 1,5×0,025×22,4=0,84(lít)
VH2S=0,1275 ×22,4=2,856 (lít)
Ví dụ 3. Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3) 2 (dư), thu được 23,9 gam kết tủa đen.
a) Viết các phương trình hóa học của phản ứng đã xảy ra.
b) Hỗn hợp khí thu được gồm những khí nào? Thể tích mỗi khí là bao nhiêu (đktc)?
c) Tính khối lượng của Fe và FeS có trong hỗn hợp ban đầu.
Hướng dẫn:
Các phản ứng xảy ra:
Fe + 2HCl → FeCl2 + H2 ↑ (1)
(mol) x → x
FeS + 2HCl → FeCl2 + H2 S ↑ (2)
(mol) y → y
H2 S + Pb(NO3 ) 2 → PbS↓+ 2HNO3 (3)
(mol) 0,1 ←0,1
Gọi x và y lần lượt là số mol của Fe và FeS
Ta có: nFeS =0,1(mol) và nkhí =0,11 (mol)
Hỗn hợp khí thu được gồm H2 và H2 S
Từ (3) ⇒ nH2 = y = nPbS = 0,1 mol (*)
Từ (1), (2) ta có: x + y=0,11 (**)
Từ (*) và (**)⇒ x=0,01; y=0,1
Vậy: VH2 =0,01 ×22,4=1,224(lít) ; VH2S =22,4 ×0,1=2,24(lít)
c) Từ (1) ⇒ nFe =nH2=0,01 (mol) ⇒ mFe = 0,01 ×56=0,56 (gam)
Từ (2) ⇒ nFeS = nH2S=0,1(mol) ⇒s mFeS = 0,1 ×88=8,8(gam)
Ví dụ 4. Đun nóng hỗn hợp 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh thu được hỗn hợp X. Cho hỗn hợp X phản ứng hoàn toàn với 500ml dung dịch HC1 thu được hỗn hợp khí A và dung dịch B. Biết H = 100%).
Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp (X).
Biết rằng cần phải dùng 125 ml dung dịch NaOH 0,1M để trung hòa HCl dư trong dung dịch B. Hãy tính nồng độ mol/l của dung dịch HCl đã dùng.
Hướng dẫn:
Tính phần trăm thể tích mỗi khí trong A
Ta có: nFe =
=0,1(mol); nS =
=0,05 (mol)
Phản ứng: Fe + S
FeS (1)
(mol) 0,05 ←0,05 → 0,05
Từ (1) ⇒ nFe : nS =1 : 1 và nFe = 0,1 ; nS=0,05 ⇒ Sau phản ứng (1) thì Fe còn dư
Fedư + 2HCl → FeCl2 + H2 ↑ (2)
(mol) 0,05 → 0,1 0,05
FeS + 2HCl → FeCl2 + H2 S ↑ (3)
(mol) 0,05 → 0,1 0,05
Từ (2), (3) ⇒ nH2= nH2S=0,05(mol)⇒%V H2S=50%
Ta có: nNaOH = 0,125 × 0,1=0,0125 (mol)
Phản ứng: HCl dư + NaOH → NaCl + H2 O (4)
(mol) 0,0125 ←0,0125
Từ (2), (3), (4) ⇒ ∑nHCl =0,1 +0,1 + 0,0125= 0,2125 (mol)
Vậy :
-
Ví dụ 5. Có hai muối là natri hiđrosunfit và sắt sunfua. Cho hai muôi này tác dụng với axit HCl dư, thu được hai chất khí. Cho hai chất khí vừa thu được tác dụng với nhau, tạo thành 9,6 gam chất rắn. Tính khối lượng của NaHSO3 và FeS đã lấy để phản ứng. Biết hai khí tác dụng với nhau vừa đủ
Hướng dẫn:
Phản ứng:
NaHSO3 + HCl → NaCl + SO2 ↑ + H2O (1)
(mol) 0,1 ← 0,1
FeS + 2HCl → FeCl2 + H2S ↑ (2)
(mol) 0,2 ← 0,2
SO2+ 2H2S → 3S↓ + 2H2O (3)
(mol) 0,1 0,2 ← 0,3
Ta có:
Từ (1) ⇒ nNaHSO3=0,1(mol)⇒ mNaHSO3=0,1×104=10,4(gam)
Từ (2) ⇒ nFeS=0,2(mol) ⇒ mFeS = 0,2 ×88 = 17,6 (gam)
-
Ví dụ 1:Chia 75,2 gam hỗn hợp X gồm FeXOY và Fe thành hại phần bằng nhau. Hòa tan phần 1 trong V ml dung dịch HCl 1M (vừa đủ) thu được 1,12 lít H2 (đktc). Phần 2 cho tác dụng với dung địch H2SO4 đặc, nóng (dư) thấy có 3,36 lít khí SO2 (đktc) thoát ra.
a) Xác định công thức oxit sắt.
b) Tính giá tri của V.
Hướng dẫn:
Xác định công thức oxit sắt
+) Phần 1: Tác dụng với HCl:
Phản ứng:
Fex O Y + 2yHCl → xFeCl2y/x + yH2 O
(mol) a 2a
Fe + 2HCl → FeCl2 + H2 ↑
(mol) b 2b b
Ta có : nH2 = b = 1,12/22,4 = 0,05 (mol)
+) Phần 2: Tác dụng với H2SO4 đặc, nóng
Ta có:
⇒ (3x – 2y)a + 0,15 =0,3 ⇒ (3x – 2y)a=0,15 (1)
Mặt khác:
(56x + 16y)a + 56 × 0,05 =
=37,6 ⇒ (56x+ 16y)a=34,8 (2) Giải (1) và (2), ta được:
⇒ Công thức của oxit sắt là Fe3O4
b) Ta có: a=
⇒ nHCl = 2ya + 2b=2(4×0,15 +0,15) =1,5 (mol) ⇒ Vdd HCl=1500 ml
Ví dụ 2: Hòa tan hết 30 gam hỗn hợp gồm một số kim loại trong dung dịch H2SO4 đặc, nóng (dư), thấy thoát ra 0,15 mol SO2; 0,1 mol S và 0,05 mol H2S.
a)Tính số mol H2SO4 đã phản ứng.
b) Tính khối lượng muối thu được sau phản ứng
Hướng dẫn:
a) Ta có: nH2SO4 phản ứng = 2nSO2+4ns+5nH2S= 2×0,15 + 4×0,1 + 5×0,05=0,95 (mol)
b)
⇒ mmuối = mkì +mSO42-tạo muối =30 + 0,65 ×96=92,4 (gam)
Ví dụ 3: Để 11,2 gam bột sắt ngoài không khí sau một thời gian thu được chất rắn X. Hòa tan hoàn toàn X trong dung dịch H2SO4 đặc, nóng (dư), thu được dung dịch Y và khí SO2 thoát ra (giả sử SO2 là sản phẩm khử duy nhất). Tính khối lượng muối khan thu được trong dung dịch Y.
Hướng dẫn:
Ta có: nFe =
=0,2 (mol)
Áp dụng định luật bảo toàn nguyên tố, ta có:
⇒ mmuối =400×0,1=40 (gam)
Ví dụ 4. Hòa tan hết 49,6 gam hỗn hợp X gồm FeCO3 và FeS trong 24 gam dung dịch H2SO4 98% đun nóng, thu được dung dịch có khôi lượng giảm m gam và 36,96 lít (đktc) hỗn hợp khí CO2 và SO2. Tính số mol axit còn dư và giá trị của m.
Hướng dẫn:
Ta có: ban đầu =
Phản ứng:
2FeCO3 + 4 H2SO4 → Fe2 (SO4)3 + SO2 ↑+2CO2 ↑+ 4H2 O
(mol) x 4x 0,5x x
2FeS +10 H2SO4 → Fe2 (SO4)3 + 9SO2 ↑+ 10H2 O
(mol) y 5yx 4,5y
Theo đề bài, ta có hệ phương trình:
⇒ NH2SO4 dư = 2,4 – (4×0,2 + 5 ×0,3) =0,5 (mol)
Vậy: m=64×(0,5 ×0,2 + 4,5×0,3)+44×0,2-49,2=52 (gam)