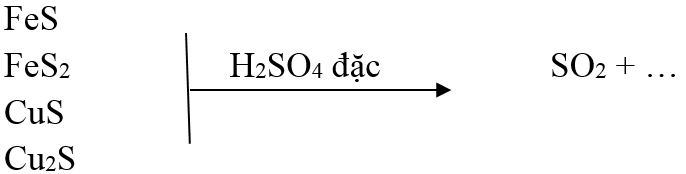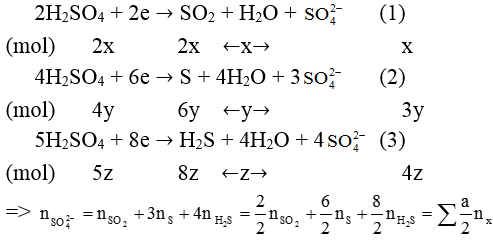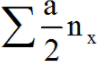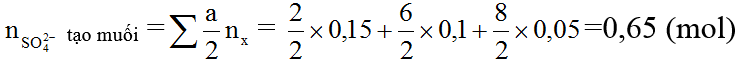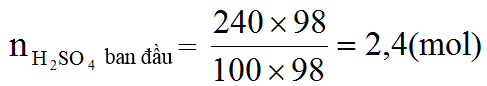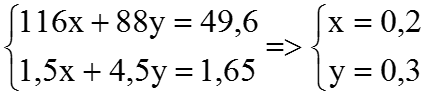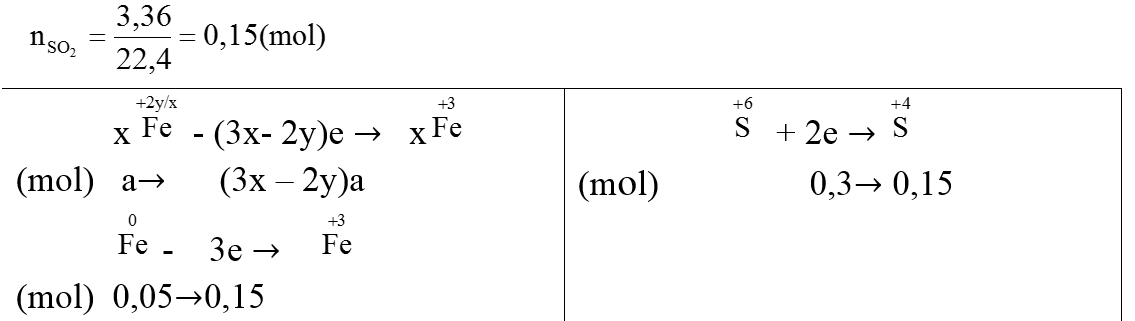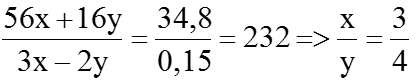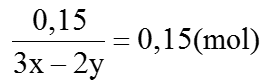Cách giải các dạng bài tập về Axit Sunfuric H2SO4 hay, chi tiết
Cách giải các dạng bài tập về Axit Sunfuric H2SO4 hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách giải các dạng bài tập về Axit Sunfuric H2SO4 hay, chi tiết
Cách giải các dạng bài tập về Axit Sunfuric H2SO4 hay, chi tiết
-
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
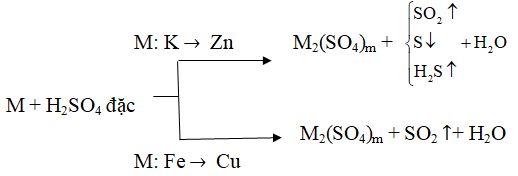
1/ Axit H2SO4 có tính axit mạnh (tương tự như HCl)
+) Tác dụng với kim loại tạo thành muối sunfat và H2
2M + nH2SO4 → M2(SO4)n + nH2 ↑
(M đứng trước H2, n là số oxi hóa thấp nhất của kim loại)
+) Tác dụng với oxit bazơ , bazơ tạo thành muối và H2O
FeO + H2SO4 → FeSO4 + H2 O
Fe3O4+ 4H2SO4 → FeSO4 + Fe2 (SO4)3 + 4H2O
Fe(OH)2 + 2H2SO4 → FeSO4 + 2H2O
+) Tác dụng với muối tọa thành muối mới và axit mới
BaCl2 + H2SO4 → BaSO4 ↓+ 2HCl
FeS + H2SO4 → FeSO4 + H2S↑
2/ Axit H2SO4 đặc có tính oxi hóa mạnh
+ Với kim loại:
(m là hóa trị cao nhất của M; Al, Fe, Cr bị thụ động hóa trong H2SO4 đặc, nguội)
+ Với phi kim
S + 2H2SO4 đặc → 3SO2↑ + 2H2O
2P + 2H2SO4 đặc → H3PO4 + SO2↑ + H2O
C + H2SO4 đặc → CO2↑ + SO2↑ + H2O
- Với hợp chất có tính khử
+) Các hợp chất Fe2+ → Fe3+
+) Các hợp chất S-1, S-2 → S+4
Phản ứng:
2Fe3O4 + 10H2SO4 → 3Fe2 (SO4)3 + SO2 ↑+ 10H2O
2Fe(OH) 2 + 4H2SO4 → Fe2 (SO4)3 + SO2 ↑+ 6H2O
2FeS2+ 14H2SO4 → 3Fe2 (SO4)3+ 15SO2 ↑+ 14H2O
3/ Cách tính nhanh số mol anion SO42- tạo muối và số mol H2SO4 tham gia phản ứng trong phản ứng oxi – hóa khử
Không phụ thuộc vào bản chất và số lượng các kim loại, ta luôn có các bán phản ứng khử:
(a là số electron mà S+6nhận vào để tạo ra sản phẩm khử X)
Chú ý: nSO4-2tạo muối =
nH2SO4phản ứng phản ứng = 2nSO2 + 4ns + 5nH2S
(Hai biểu thức trên chỉ áp dụng nếu hỗn hợp ban đầu là các kim loại)

-
Ví dụ minh họa
Ví dụ 1: Hòa tan hết 30 gam hỗn hợp gồm một số kim loại trong dung dịch H2SO4 đặc, nóng (dư), thấy thoát ra 0,15 mol SO2; 0,1 mol S và 0,05 mol H2S.
a)Tính số mol H2SO4 đã phản ứng.
b) Tính khối lượng muối thu được sau phản ứng
Hướng dẫn:
a) Ta có: nH2SO4 phản ứng = 2nSO2+4ns+5nH2S= 2×0,15 + 4×0,1 + 5×0,05=0,95 (mol)
b)
⇒ mmuối = mkim loại + mSO42-tạo muối =30 + 0,65 ×96=92,4 (gam)
Ví dụ 2: Để 11,2 gam bột sắt ngoài không khí sau một thời gian thu được chất rắn X. Hòa tan hoàn toàn X trong dung dịch H2SO4 đặc, nóng (dư), thu được dung dịch Y và khí SO2 thoát ra (giả sử SO2 là sản phẩm khử duy nhất). Tính khối lượng muối khan thu được trong dung dịch Y.
Hướng dẫn:
Ta có: nFe =
=0,2 (mol)
Áp dụng định luật bảo toàn nguyên tố, ta có:
⇒ mmuối =400×0,1=40 (gam)
Ví dụ 3. Hòa tan hết 49,6 gam hỗn hợp X gồm FeCO3 và FeS trong 24 gam dung dịch H2SO4 98% đun nóng, thu được dung dịch có khôi lượng giảm m gam và 36,96 lít (đktc) hỗn hợp khí CO2 và SO2. Tính số mol axit còn dư và giá trị của m.
Hướng dẫn:
Ta có:
Phản ứng:
2FeCO3 + 4 H2SO4 → Fe2(SO4)3 + SO2 ↑ + 2CO2 ↑+ 4H2 O
(mol) x 4x 0,5x x
2FeS + 10 H2SO4 → Fe2(SO4)3 + 9SO2 ↑+ 10H2 O
(mol) y 5yx 4,5y
Theo đề bài, ta có hệ phương trình:
⇒ nH2SO4 dư = 2,4 – (4×0,2 + 5 ×0,3) =0,5 (mol)
Vậy: m = 64 ×(0,5 × 0,2 + 4,5 × 0,3)+ 44 × 0,2 - 49,2 = 52 (gam)
-
Ví dụ 4:Chia 75,2 gam hỗn hợp X gồm FexOy và Fe thành hại phần bằng nhau. Hòa tan phần 1 trong V ml dung dịch HCl 1M (vừa đủ) thu được 1,12 lít H2 (đktc). Phần 2 cho tác dụng với dung địch H2SO4 đặc, nóng (dư) thấy có 3,36 lít khí SO2 (đktc) thoát ra.
a) Xác định công thức oxit sắt.
b) Tính giá tri của V.
Hướng dẫn:
Xác định công thức oxit sắt
+) Phần 1: Tác dụng với HCl:
Phản ứng:
FexOy + 2yHCl → xFeCl2y/x + yH2O
(mol) a 2a
Fe + 2HCl → FeCl2 + H2 ↑
(mol) b 2b b
Ta có : nH2 = b = 1,12/22,4 = 0,05 (mol)
+) Phần 2: Tác dụng với H2SO4 đặc, nóng
Ta có:
⇒ (3x – 2y)a + 0,15 =0,3 ⇒ (3x – 2y)a=0,15 (1)
Mặt khác:
(56x + 16y)a + 56 × 0,05 =
=37,6 ⇒ (56x+ 16y)a=34,8 (2) Giải (1) và (2), ta được:
⇒ Công thức của oxit sắt là Fe3O4
b) Ta có: a=
⇒ nHCl = 2ya + 2b = 2(4 × 0,15 + 0,15) = 1,5 (mol) ⇒ Vdd HCl=1500 ml
-
B. Bài tập trắc nghiệm
Câu 1. Trộn 200 ml dung dịch NaOH 1M với 150ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
-
Câu 2. Hòa tan hoàn toàn 49,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 Fe3O4 bằng H2SO4 đặc, nóng thu được dung dịch Y và 8,96 lít SO2 (đktc)
a, Tính phần trăm khối lượng của oxi trong hỗn hợp X.
b, Tính khôi lượng muối thu được trong dung dịch Y
Câu 3. Hòa tan 0,4 gam SO3 vào a gam dung dịch H2SO4 10% thu được dung dịch H2SO4 12,25%.
a) Tính a
b) Thêm 10 ml dung dịch Ba(OH)2 0,5 M vào dung dịch thu được ở trên lọc kết tủa thêm tiếp 50 ml dung dịch NaOH 0,8 M vào nước lọc rồi cho bay hơi thu được 6,44 gam chất rắn X. Xác định công thức của X.
Câu 4. Cho 14,2 gam hỗn hợp A gồm ba kim loại Al, Fe và M vào dung dịch H2SO4 loãng dư thu được 8,96 lít H2 (54oC; 1,2 atm), dung dịch B và 3,2 gam rắn C. Hòa tan toàn bộ rắn C vào dung dịch H2SO4 đậm đặc nóng thoát ra V lít khí E (có mùi hắc) (đktc).
a) Xác định kim loại M (biết V lít khí E làm mất màu vừa đủ 50ml dung dịch Br2 1M).
b) Tính % khối lượng mỗi kim loại trong hỗn hợp A.
Câu 5. Khi pha loãng H2SO4 cần làm như sau:
A. Cho từ từ H2SO4 đặc vào nước và khuấy đều
B. Cho từ từ nước vào H2SO4 đặc và khuấy đều
C. Cho nước và axit đồng thời
D. Lấy 2 phần nước pha với một phần axit.
Câu 6. Cho phương trình phản ứng hóa học:
H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI là chất oxi hóa
C. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI
D. I2 khử H2S thành H2SO4 và nó bị khử thành HI.
Câu 7. Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10% thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là:
A. 101,48g B. 101,68g C. 97,80g D. 88,20g
-
-
Câu 8. Cho 80 gam SO3 vào một cốc nước sau đó thêm nước vào đến vạch 0,5 lít thì dừng (gọi là dung dịch A).
a, Tính nồng độ mol/l của dung dịch A.
b, Cho 20 ml dung dịch A vào dung dịch BaCl4 dư. Hãy tính khối lượng kết tủa thu được.
c, Để trung hòa 20ml dung dịch KOH thì cần 10ml dung dịch A. Tính nồng độ mol/l của dung dịch KOH.