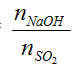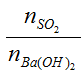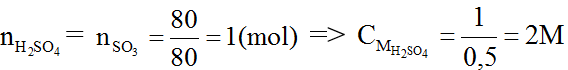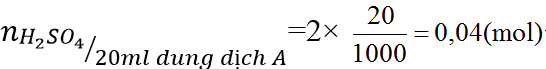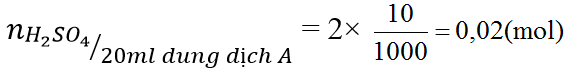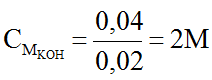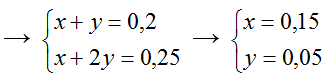Bài tập về SO2, H2S, SO3, H2SO4 phản ứng với dung dịch kiềm hay, chi tiết
Bài tập về SO2, H2S, SO3, H2SO4 phản ứng với dung dịch kiềm hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Bài tập về SO2, H2S, SO3, H2SO4 phản ứng với dung dịch kiềm hay, chi tiết
Bài tập về SO2, H2S, SO3, H2SO4 phản ứng với dung dịch kiềm hay, chi tiết
-
Phương pháp:
Bài toán 1: SO2 + NaOH hoặc KOH
SO2 + NaOH → NaHSO3 (1)
SO2 + 2NaOH → Na2 SO3 + H2 O (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối NaHSO3 (muối axit)
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối NaHSO3 và Na2 SO3
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Na2 SO3 (muối trung hòa)
Bài toán 2: SO2 + Ba(OH) 2 /Ca(OH) 2
SO2 + Ba(OH) 2 → BaSO3 ↓+ H2 O (1)
2SO2 + Ba(OH) 2 → Ba(HSO3) 2 (2)
Lập tỉ lệ T =
T≤ 1 → chỉ xảy ra phản ứng (1) tức tạo muối BaSO3 ↓
1<T<2 → xảy ra cả (1) và (2) tức tạo 2 muối BaSO3↓ và Ba(HSO3)2
T≥ 2 → chỉ xảy ra phản ứng (2) tức tạo muối Ba(HSO3) 2 (muối tan, không tạo kết tủa)

-
-
Ví dụ 1. Cho 80 gam SO3 vào một cốc nước sau đó thêm nước vào đến vạch 0,5 lít thì dừng (gọi là dung dịch A).
a) Tính nồng độ mol/l của dung dịch A.
b) Cho 20 ml dung dịch A vào dung dịch BaCl2 dư. Hãy tính khối lượng kết tủa thu được.
c) Để trung hòa 20ml dung dịch KOH thì cần 10ml dung dịch A. Tính nồng độ mol/l của dung dịch KOH.
Hướng dẫn:
Ta có: nSO3 = 80/80 = 1
SO3 + H2O → H2SO4 (1)
(mol) 1 → 1
Từ (1) ⇒
Phản ứng:
H2SO4 + BaCl2 → BaSO4 ↓+ 2HCl (2)
(mol) 0,04 → 0,04
Ta có:
Từ (2) ⇒nBaSO4= 0,04(mol) ⇒ mBaSO4=0,04 × 233=9,32 (gam)
Ta có:
2KOH + H2SO4 → K2SO4 + 2H2O (3)
(mol) 0,04 ← 0,02
Từ (3) ⇒ nKOH = 0,04 (mol) ⇒

Ví dụ 2: Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M. Tính khối lượng muối tạo thành sau phản ứng.
Hướng dẫn:
nSO2 =
= 0,2 mol
nNaOH = 0,25.1 = 0,25 mol
1 < T =
= 1,25 < 2
→ Tạo 2 muối NaHSO3 và Na2 SO3
PTHH:
SO2 + NaOH → NaHSO3
x mol → x mol x
SO2 + 2NaOH → Na2 SO3 + H2 O
y mol → 2y mol y
→ mNaHSO3 = 0,15. 104 = 15,6g
mNa2O3 = 0,05 . 126 = 6,3g
Nhận xét : Có thể nhẩm nhanh trắc nghiệm: số mol 2 muối = số mol SO2
n Na2O3 = nNaOH - nSO2 = 0,25 – 0,2 = 0,05 mol
n NaHSO3 = nSO2 - n Na2O3 = 0,2 – 0,05 = 0,15 mol
Ví dụ 3: Hấp thụ 6,72 lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH) 2 2M. Tính khối lượng muối thu được
Hướng dẫn:
NSO2 = 0,3 mol; nBa(OH)2 = 0,2 mol
1 < T =
= 1,5 < 2
→ tạo 2 muối
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
a mol → a mol a
Ba(OH) 2 + 2SO2 → Ba(HSO3)2
b mol → 2b b
→ mBaSO3 = 0,1 . 217 = 12,7g
mBa(HSO3)2 = 0,1.299 = 29,9g
Cách 2:
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
x mol → x mol → x mol
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
x mol → x mol
tạo kết tủa, khi dư SO2, kết tủa bị hòa tan, để hòa tan hết kết tủa nSO2 ít nhất = 2x= 2nBa(OH)2
Nếu lượng SO2 không đủ để hòa tan hết kết tủa, thì kết tủa chỉ bị tan một phần tức tồn tại 2 muối BaSO3 và Ba(HSO3) 2
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,2 → 0,2 0,2
BaSO3 + SO2dư + H2O → Ba(HSO3) 2
0,1 ← (0,3-0,2) → 0,1
NBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
Cách 3: Nhẩm trắc nghiệm: để hòa tan hết kết tủa nSO2 = 2nBa(OH)2 , nếu lượng kết tủa chỉ bị tan một phần
NSO2 = 2nBa(OH)2 - nkết tủa (vì tỉ lệ số mol hòa tan kết tủa là 1:1)
→ nBaSO3còn lại = 2nBa(OH)2 - nSO2 = 2.0,2 – 0,3 = 0,1 mol
Số mol 2 muối = số mol Ba(OH) 2 → nBa(HSO3)2 = nBa(OH)2 - nBaSO3còn lại = 0,2 – 0,1 = 0,1 mol
→ mBaSO3 = 0,1 . 217 = 12,7g
MBa(HSO3)2 = 0,1.299 = 29,9g
Ví dụ 4: Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
Hướng dẫn:
Trường hợp 1: Ba(OH) 2dư, SO2 hết , nSO2 = n BaSO3
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 ←0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH) 2hết, SO2dư nhưng không hòa tan hết kết tủa ( kế t tủa chỉ tan một phần)
a(OH) 2 + SO2 → BaSO3↓+ H2O
0,1 0,1 ←0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
(tính nhanh nSO2 = 2nBa(OH)2 - n↓ = 2. 0,3 – 0,1 = 0,5 mol)
Ví dụ 5: Dẫn khí SO2 qua 200 ml dung dịch Ba(OH) 2 aM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính a
Hướng dẫn:
Thêm NaOH lại thu thêm kết tủa, chứng tỏ trong dung dịch tồn tại muối Ba(HSO3) 2, mà vẫn có kết tủa
→ tồn tại 2 muối
n↓(1) = = 0,1 mol
n↓(2) = = 0,05 mol
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
0,05 ←0,05
Ba(HSO3) 2 + 2NaOH → BaSO3 ↓ + Na2SO3 + 2H2O
0,05 ←0,05
nBa(OH)2 = 0,1 + 0,05 = 0,15 mol → a = = 0,75M
Cách 2:
↓ = 0,1 + 0,05 = 0,15 mol
Ba(OH) 2 → BaSO3
0,15 ←0,15
→ a =
= 0,75M
Ví dụ 6. Trộn 200 ml dung dịch NaOH 1M với 150ml dung dich H2SO4 1M. Hỏi sau khi phản ứng kết thúc khôi lượng muối thu được là bao nhiêu?
Hướng dẫn:
Ta có: nNaOH =0,2 × 1=0,2(mol); nH2SO4= 0,15 mol
Phản ứng: NaOH + H2SO4 → NaHSO4 + H2O
(mol) 0,15← 0,15 → 0,15
NaOH + NaHSO4 → Na2SO4 + H2O
(mol) 0,05 → 0,05
⇒ nNaHSO4dư = 0,15 – 0,05 =0,1 (mol)
⇒ mmuối = mNaHSO4 + mNa2SO4=120 ×0,1 + 142×0,05=19,1(gam)
-
-
Ví dụ 7: Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch NaOH aM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
Hướng dẫn:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2NaOH → Na2 SO3 + H2 O
0,15 → 0,3
NSO2 = 0,15 mol , VNaOH = 200 ml = 0,2 lít
→ a = CM (NaOH)=
= 0,75M