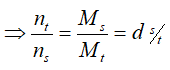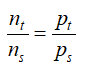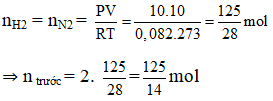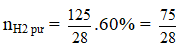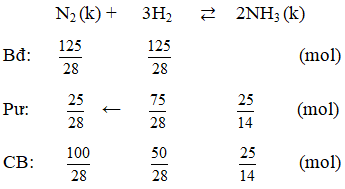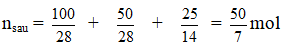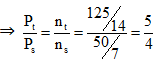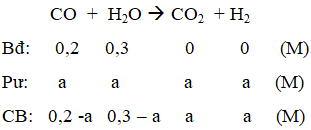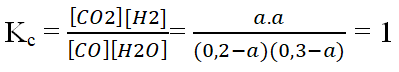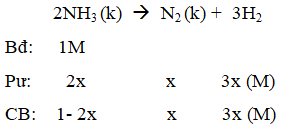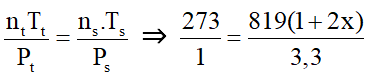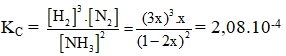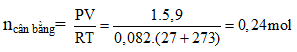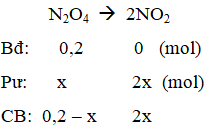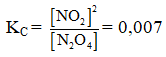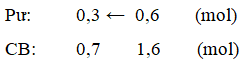Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
Phương pháp Tính nồng độ các chất ở trạng thái cân bằng cực hay
-
Phương pháp giải
Xét phản ứng đồng thể đơn giản tổng quát:
aA + bB ↔ cC + dD
- Khi hệ đạt trạng thái cân bằng: vthuận = vnghịch
: Hằng số cân bằng biểu diễn theo nồng độ(đối với dung dịch)
: Hằng số cân bằng biểu diễn theo áp suất riêng phần(đối với chất khí)
(Nồng độ các chất và áp suất các chất tại thời điểm cân bằng)
- Trong bình kín thì mt = ms
- Bình kín, nhiệt độ không đổi thì
-

-
Ví dụ minh họa
-
Ví dụ 1: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
A. 10 atm. B. 8 atm.
C. 9 atm. D. 8,5 atm.
Hướng dẫn giải:
(hiệu suất tính theo H2)
Ta có thể tích và nhiệt độ không đổi
⇒ Psau = 10 : 5/4 = 8 atm
⇒ Đáp án B
Ví dụ 2: Trong bình kín dung tích 1 lít, người ta cho vào 5,6 gam khí CO và 5,4 gam hơi nước. Phản ứng xảy ra là :CO + H2O → CO2 + H2. Ở 850oC hằng số cân bằng của phản ứng trên là 1. Nồng độ mol của CO và H2O khi đạt đến cân bằng lần lượt là :
A. 0,2 M và 0,3 M.
B. 0,08 M và 0,2 M.
C. 0,12 M và 0,12 M.
D. 0,08 M và 0,18 M.
Hướng dẫn giải:
Ban đầu: [CO] = 0,2M; [H2O] = 0,3M
Gọi [CO]pư = Am
Tại cân bằng: [CO] = 0,2 – a; [H2O] = 0,3 – a; [CO2] = a; [H2] = a
a = 0,12 ⇒ [CO] = 0,08M; [CO2] = 0,18M
⇒ Đáp án D
Ví dụ 3: Một bình kín chứa NH3 ở 0oC và 1 atm với nồng độ 1 mol/l. Nung bình kín đó đến 546oC và NH3 bị phân huỷ theo phản ứng :2NH3(k) → N2(k) + 3H2(k). Khi phản ứng đạt tới cân bằng áp suất khí trong bình là 3,3 atm, thể tích bình không đổi. Hằng số cân bằng của phản ứng phân huỷ NH3 ở 546oC là :
A. 1,08.10-4.
B. 2,08.10-4.
C. 2,04.10-3.
D. 1,04.10-4.
Hướng dẫn giải:
Gọi nồng độ NH3 phản ứng là 2x
Vì thể tích dung dịch không đổi nên:
⇒ x = 0,05
Ta có:
⇒ Đáp án C
Ví dụ 4: Cho cân bằng :N2O4 → 2NO2. Cho 18,4 gam N2O4 vào bình chân không dung tích 5,9 lít ở 27oC, khi đạt đến trạng thái cân bằng, áp suất là 1 atm. Hằng số cân bằng KC ở nhiệt độ này là :
A. 0,040. B. 0,007.
C. 0,00678. D. 0,008.
Hướng dẫn giải:
nN2O4 = 0,2 mol
Gọi nN2O4 pư = x mol
ncân bằng = 0,2 – x + 2x = 0,2 + x = 0,24 ⇒ x = 0,04 mol
⇒ [NO2] = 0,04 : 5,9 = ; [N2O4] = 8/295
⇒ Đáp án B
-
-
Ví dụ 5: Cho phương trình phản ứng :2A(k) + B (k) ↔ 2X (k) + 2Y(k) Người ta trộn 4 chất, mỗi chất 1 mol vào bình kín dung tích 2 lít (không đổi). Khi cân bằng, lượng chất X là 1,6 mol. Nồng độ B ở trạng thái cân bằng lần lượt là :
A. 0,7M B. 0,8M.
C. 0,35M. D. 0,5M.
Hướng dẫn giải:
Ban đầu có sẵn 1 mol X nên số mol X được tạo ra là 1,6 - 1 = 0,6 mol
2A(k) + B(k) ↔ 2X(k) + 2Y(k)
BĐ (n0): 1 1 1 1 (mol)
⇒ [B] = 0,7 : 3 = 0,35M
⇒ Đáp án C