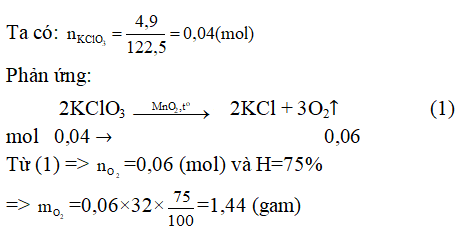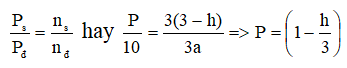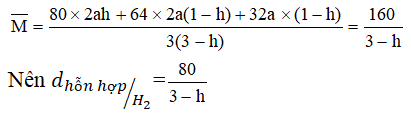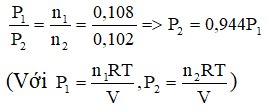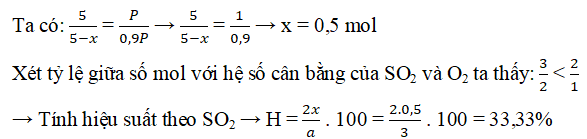Cách tính Hiệu suất phản ứng tổng hợp SO3, O3 hay, chi tiết
Cách tính Hiệu suất phản ứng tổng hợp SO3, O3 hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách tính Hiệu suất phản ứng tổng hợp SO3, O3 hay, chi tiết
Cách tính Hiệu suất phản ứng tổng hợp SO3, O3 hay, chi tiết
-
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Trên thực tế hầu hết các phản ứng hóa học xảy ra không hoàn toàn, nghĩa là hiệu suất phản ứng (H%) dưới 100%.
Hiệu suất phản ứng được tính như sau:
Trừ trường hợp đề yêu cầu cụ thể tính hiệu suất phản ứng theo chất nào thì ta phải tính theo chất ấy. Còn khi ta biết lượng của nhiều chất tham gia phản ứng, để tính hiệu suất chung của phản ứng, ta phải:
So sánh tỉ lệ mol của các chất này theo đề cho và theo phản ứng.
- Nếu tỉ lệ mol so sánh là như nhau, thì hiệu suất phản ứng tính theo chất tham gia vào cũng cho cùng một kết quả.
- Nếu tỉ lệ mol so sánh là khác nhau, thì hiệu suất phản ứng không được tính theo chất luôn luônắn (ngay cả khi ta giả sử chất kia phản ứng hết).

-
Ví dụ minh họa
Ví dụ 1: Điều chế khí O2 , người ta nhiệt phân KClO3 có xúc tác MnO2. Nếu tiến hành nhiệt phân 4,9 gam KClO3 thì khối lượng oxi thu được là bao nhiêu? Biết hiệu suất phản ứng là 75%.
Hướng dẫn:
Ví dụ 2: Trong một bình kín dung tích không đổi chứa a mol O2 và 2a mol SO2 ở 100oC, 10atm (có mặt xúc tác V2O5). Nung nóng bình một thời gian, sau đó làm nguội bình tới 100oCC. Áp suất trong bình lúc đó là P. Thiết lập biểu thức tính Pp và tỉ khối (d) so với hiđro của hỗn hợp khí trong bình sau phản ứng theo hiệu suất phản ứng H. Hỏi P và d có giá trị trong khoảng nào?
Hướng dẫn:
Số mol hỗn hợp SO2 và O2: a + 2a = 3a (mol)
Phản ứng: 2SO2 + O2 → 2SO3
Số mol SO2 tham gia phản ứng: 2ah (mol)
Theo tỉ lệ phản ứng nhận thấy:
Cứ 2(mol) SO2 phản ứng,làm số mol hỗn hợp giảm 1 (mol)
Vậy khi 2ah (mol) SO2 phản ứng, làm số mol hỗn hợp giảm: ah (mol)
⇒ Số mol hỗn hợp sau phản ứng: 3a – ah = a(3 – h) (mol)
Áp dụng công thức: PV= nRT cho hỗn hợp ban đầu và hỗn hợp sau phản ứng, ta có:
+) Khi h = 0 ⇒ P = 10 atm
+) Khi h = 1 ⇒ P = 20/3 atm
Do đó: 20/3 < P < 10
Khối lượng phân tử trung bình của hỗn hợp sau phản ứng:
+) Khi h = 0 ⇒ d = 80/3
+) Khi h = 1 ⇒ d = 40
Vậy giới hạn của tỉ khối d: 80/3 < d < 40
Ví dụ 3: Một bình kín đựng oxi ở nhiệt độ toC có áp suất P1 (atm), sau khi phóng tia lửa điện để chuyển oxi thành ozon bình được đưa về nhiệt độ ban dầu, áp suất khí trong bình lúc này là P2. Tiếp tục dẫn khí trong bình qua dung dịch KI (dư) thu được dung dịch A và 2,2848 lít khí (đktc).
a, Tính hiệu suất của quá trình ozon hóa. Biết rằng để trung hòa dung dịch A cần dùng 150ml dung dịch H2SO4 0,08M.
b,Tính P2 theo P1.
Hướng dẫn:
a,Phương trình phản ứng:
b, Theo phương trình trạng thái khí lí tưởng. Nếu phản ứng xảy ra ở điều kiện nhiệt độ và thể tích không đổi thì ta có:
-
Ví dụ 4: Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình kín có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%. Tính hiệu suất của phản ứng trên.
Hướng dẫn:
Gọi x là số mol oxi đã phản ứng, ta có:
Tổng số mol khí trước phản ứng là: 3 + 2 = 5 mol
Tổng số mol khí sau phản ứng là: 5 – x
Phản ứng: 2SO2 + O2 ↔ 2SO3
-
B. Bài tập trắc nghiệm
-
Câu 1. Trộn 3 mol SO2 với 2 mol O2, cho hỗn hợp vào bình xin có chứa sẵn chất xúc tác, bật tia lửa điện để phản ứng xảy ra. Sau phản ứng, đưa bình về điều kiện ban đầu thì thấy áp suất trong bình giảm đi 10%, Vậy hiệu suất của phản ứng trên là:
A. 90% B. 60,67% C. 33,33% D. 50,2%
Câu 2. Trong một bình kín dung tích không đổi chứa a mol SO2 , a mol O2 và một ít bột xúc tác V2O5; áp suất và nhiệt độ trong bình là P atm và toC. Nung nóng bình một thời gian, sau đó đưa nhiệt độ bình về toC, áp suất trong bình lúc này là P’. Lập biểu thức P theo P và h (hiệu suất phản ứng). Hỏi P’ có giá trị trong khoảng nào, biết rằng ở toC các chất đều ở thế khí.
Câu 3. Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (D = 1,83 g/ml)? Giả thiết tỉ lệ hao hụt là 5%.
A. 473 m3 B. 547 m3 C. 324 m3 D. 284m3
Câu 4. Đốt cháy hoàn toàn 80 gam pirit sắt trong không khí thu được chất rắn A và khí B. Lượng chất rắn A tác dụng vừa đủ với 200g H2SO4 29,4%. Độ nguyên chất của quặng là:
A. 60% B. 70% C. 80% D. 95%
Câu 5. Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt cháy là
A. 74,69% B. 95,00% C. 25,31% D. 64,68%
-
- Câu 6. Trong một bình kín dung tích không đổi chứa a mol SO2, a mol O2 và một ít bột xúc tác V2O5, áp suất và nhiệt độ trong bình là P atm và toC. Nung nóng bình một thời gian, sau đó đưa nhiệt độ bình về toC, áp suất trong bình lúc này là P. Lập biểu thức P’ theo P và H (hiệu suất phản ứng). Hỏi P’ có giá trị trong khoảng nào? Biết ở toC các chất đều ở thể tích khí.