Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử
Lời giải Bài 10.12 trang 29 SBT Hóa học 10 sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải SBT Hóa học 10 Kết nối tri thức Bài 10. Quy tắc octet
Bài 10.12 trang 29 SBT Hóa học 10: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: O2, CO2, CaCl2, KBr.
Lời giải:
- Nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử O2, mỗi nguyên tử O góp chung 2 electron tạo thành cặp electron dùng chung. Khi đó mỗi nguyên tử O đều có 8 electron lớp ngoài cùng, thỏa mãn quy tắc octet.

- Nguyên tử C có 4 electron lớp ngoài cùng, nguyên tử O có 6 electron lớp ngoài cùng. Để tạo thành phân tử CO2, nguyên tử C góp chung với mỗi O 2 electron. Khi đó C và O đều thỏa mãn quy tắc octet.

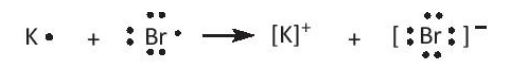
- Nguyên tử K có 1 electron lớp ngoài cùng, nguyên tử Br có 7 electron lớp ngoài cùng. Để tạo thành phân tử KBr, nguyên tử K nhường 1 electron tạo ion K+, nguyên tử Br nhận 1 electron từ nguyên tử K tạo ion Br-. Hai ion trái dấu hút nhau để tạo thành phân tử KBr.
- Nguyên tử Ca có 2 electron lớp ngoài cùng, nguyên tử Cl có 7 electron lớp ngoài cùng. Để tạo thành phân tử CaCl2, nguyên tử Ca nhường 2 electron để tạo thành ion Ca2+, mỗi nguyên tử Cl nhận 1 electron từ nguyên tử Ca để tạo thành ion Cl-. Các ion trái dấu hút nhau tạo thành phân tử CaCl2

Xem thêm các bài giải sách bài tập Hóa học 10 bộ sách Kết nối tri thức hay, chi tiết khác:
Bài 10.1 trang 28 SBT Hóa học 10: Liên kết hóa học là..
Bài 10.7 trang 28 SBT Hóa học 10: Quy tắc octet không đúng với trường hợp nào sau đây?
Bài 10.8 trang 29 SBT Hóa học 10: Trong tự nhiên, các khí hiếm tồn tại dưới dạng nguyên tử tự do...
Bài 10.9 trang 29 SBT Hóa học 10: Cấu hình electron lớp ngoài cùng của nguyên tử potassium (kali) là 4s1,...
Bài 10.10 trang 29 SBT Hóa học 10: Khi hình thành liên kết H + Cl → HCl và khi phá vỡ liên kết HCl → H + Cl thì hệ thu năng lượng hay tỏa năng lượng. ..
Bài 10.11 trang 29 SBT Hóa học 10: Trong phân tử Na2S, cấu hình electron của các nguyên tử có tuân theo quy tắc octet không?
Bài 10.12 trang 29 SBT Hóa học 10: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: O2, CO2, CaCl2, KBr.
Bài 10.13 trang 29 SBT Hóa học 10: Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng, …
Bài 10.14 trang 29 SBT Hóa học 10: Hợp chất X tạo bở hai nguyên tố A, D có khối lượng phân tử là 76....


