Sách bài tập Hóa học 10 Bài 19 Kết nối tri thức: Tốc độ phản ứng
Với giải sách bài tập Hóa học 10 Bài 19. Tốc độ phản ứng sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa học 10 Bài 19.
Giải sách bài tập Hóa học 10 Bài 19. Tốc độ phản ứng - Kết nối tri thức
Nhận biết
Bài 19.1 trang 53 SBT Hóa học 10: Cho phản ứng xảy ra trong pha khí sau:
Biểu thức tốc độ trung bình của phản ứng là
A.
B.
C.
D.
Lời giải
Đáp án đúng là: D
H2 + Cl2 → 2HCl
Biểu thức tốc độ trung bình của phản ứng là
Bài 19.2 trang 53 SBT Hóa học 10: Trong dung dịch phản ứng thủy phân ethyl acetate (CH3COOC2H5) có xúc tác acid vô cơ xảy ra như sau:
CH3COOC2H5 + H2O CH3COOH + C2H5OH
A. Nồng độ acid tăng dần theo thời gian.
B. Thời điểm ban đầu, nồng độ acid trong bình phản ứng bằng 0.
C. Tỉ lệ mol giữa chất đầu và sản phẩm luôn bằng 1.
D. HCl chuyển hóa dần thành CH3COOH nên nồng độ HCl giảm dần theo thời gian.
Lời giải
Đáp án đúng là: A
A. Đúng vì sản phẩm tạo thêm acid CH3COOH
B. Sai vì ban đầu đã có acid HCl nên nồng độ acid khác 0
C. Sai khi phản ứng xảy ra hoàn toàn tỉ lệ mol giữa chất đầu và sản phẩm mới bằng 1.
D. Chất xúc tác không bị biến đổi về lượng và chất sau phản ứng.
Bài 19.3 trang 53 SBT Hóa học 10: Sục khí CO2 vào bình chứa dung dịch Na2CO3.
a) Tốc độ hấp thụ khí CO2 sẽ thay đổi như thế nào nếu thêm các chất sau đây vào dung dịch:
(i) HCl; (ii) NaCl; (iii) H2O; (iv) K2CO3.
b) Nếu tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
Lời giải
CO2 + Na2CO3 + H2O → 2NaHCO3
a) (i) giảm (do HCl phản ứng với Na2CO3 làm nồng độ Na2CO3 giảm);
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
(ii) không thay đổi;
(iii) giảm (do làm giảm nồng độ Na2CO3);
(iv) tăng (do K2CO3 cũng phản ứng với CO2).
CO2 + K2CO3 + H2O → 2KHCO3
b) Nếu tăng áp suất, tốc độ phản ứng tăng.
Bài 19.4 trang 54 SBT Hóa học 10: Cho các phản ứng hóa học sau:
a) Fe3O4(s) + 4CO(g) → 3Fe(s) + 4CO2(g)
d) CaO(s) + SiO2(s) → CaSiO3(s)
g) 2KI(aq) + H2O2(aq) → I2(s) + 2KOH(aq)
Tốc độ những phản ứng nào ở trên thay đổi khi áp suất thay đổi?
Lời giải
Tốc độ các phản ứng a, b, c, e thay đổi khi áp suất thay đổi.
Chú ý: Việc thay đổi áp suất chỉ làm ảnh hưởng đến tốc độ phản ứng khi có chất khí tham gia.
Bài 19.5 trang 54 SBT Hóa học 10: Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng?
C. Lượng muối thu được nhiều hơn.
D. Nồng độ HCl giảm nhanh hơn.
Lời giải
Đáp án đúng là: C
Đun nóng phản ứng làm tốc độ phản ứng tăng ⇒ Khí H2 thoát ra nhanh hơn, bột Fe tan nhanh hơn, nồng độ HCl giảm nhanh hơn, thu được muối nhanh hơn.
Bài 19.6 trang 54 SBT Hóa học 10: Cho phản ứng hóa học xảy ra trong pha khí sau:
Phát biểu nào sau đây không đúng?
Khi nhiệt độ phản ứng tăng lên,
A. tốc độ chuyển động của phân tử chất đầu (N2, H2) tăng lên.
B. tốc độ va chạm giữa phân tử N2 và H2 tăng lên.
C. số va chạm hiệu quả tăng lên.
D. tốc độ chuyển động của phân tử chất sản phẩm NH3 giảm.
Lời giải
Đáp án đúng là: D
Khi nhiệt độ phản ứng tăng lên, tốc độ chuyển động của phân tử chất sản phẩm NH3 tăng lên nhưng không ảnh hưởng đến tốc độ phản ứng.
Bài 19.7 trang 54 SBT Hóa học 10: Cho bột magnesium vào nước, phản ứng xảy ra rất chậm. Hãy nêu cách làm tăng tốc độ phản ứng trên.
Lời giải
Đun nóng nước để phản ứng với magnesium nhanh hơn.
Bài 19.8 trang 54 SBT Hóa học 10: Cho phản ứng hóa học sau:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Yếu tố nào sau đây không làm ảnh hưởng đến tốc độ phản ứng?
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
Lời giải
Đáp án đúng là: C
Thể tích dung dịch sulfuric acid không làm ảnh hưởng đến tốc độ phản ứng.
Bài 19.9 trang 54 SBT Hóa học 10: Phát biểu nào sau đây là đúng về xúc tác?
A. Xúc tác làm tăng năng lượng hoạt hóa của phản ứng.
B. Khối lượng xúc tác không thay đổi sau phản ứng.
C. Xúc tác không tương tác với các chất trong quá trình phản ứng.
D. Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
Lời giải
Đáp án đúng là: B
Chất xúc tác không bị biến đổi về lượng và chất sau phản ứng.
Bài 19.10 trang 55 SBT Hóa học 10: Cho phản ứng thủy phân tinh bột có xúc tác là HCl.
Phát biểu nào sau đây không đúng?
A. HCl không tác dụng với tinh bột trong quá trình phản ứng.
B. Nếu nồng độ HCl tăng, tốc độ phản ứng tăng.
C. Khi không có HCl, phản ứng thủy phân tinh bột vẫn xảy ra nhưng với tốc độ chậm.
D. Nồng độ HCl không đổi sau phản ứng.
Lời giải
Đáp án đúng là: A
HCl có tác dụng với tinh bột trong quá trình phản ứng.
Thông hiểu
Bài 19.11 trang 55 SBT Hóa học 10: Cho các phản ứng hóa học sau:
(1) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(4) CH3COOH + C2H5OH → CH3OOC2H5 + H2O
Ở điều kiện thường, phản ứng nào xảy ra nhanh, phản ứng nào xảy ra chậm?
Lời giải
Các phản ứng xảy ra nhanh: (1), (3).
Các phản ứng xảy ra chậm: (2), (4).
Bài 19.12 trang 55 SBT Hóa học 10: Thả 1 mảnh magnesium có khối lượng 0,1 g vào dung dịch HCl loãng. Sau 5 giây thấy mảnh magnesium tan hết. Hãy tính tốc độ trung bình của phản ứng hòa tan magnesium.
Lời giải
Tốc độ trung bình của phản ứng hòa tan magnesium:
Bài 19.13 trang 55 SBT Hóa học 10: Trong một thí nghiệm, người ta đo được tốc độ trung bình của phản ứng của zinc (dạng bột) với dung dịch H2SO4 loãng là 0,005 mol/s.
Lời giải
Lượng zinc đã tan là: 0,4 – 0,05 = 0,35 (mol).
Thời gian để hòa tan 0,35 mol zinc là:
Bài 19.14 trang 55 SBT Hóa học 10: Xét phản ứng: 3O2 → 2O3.
Lời giải
Tốc độ phản ứng trung bình:
Bài 19.15 trang 55 SBT Hóa học 10: Cho các phản ứng hóa học sau:
a) CH3COOC2H5(l) + H2O(l) → CH3COOH(l) + C2H5OH(l)
b) Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
c) H2C2O4(aq) + 2KMnO4(aq) + 8H2SO4(aq) → 10CO2(g)+ 2MnSO4(aq) + 8H2O(l)
Tốc độ các phản ứng trên sẽ thay đổi như thế nào nếu ta thêm nước vào bình phản ứng.
Lời giải
Tốc độ các phản ứng thay đổi khi thêm nước vào bình phản ứng:
a) Tăng (do nước tăng, nước tham gia vào phản ứng).
b) Giảm (do nước làm loãng nồng độ H2SO4).
c) Giảm (do nước làm loãng nồng độ các chất tham gia phản ứng).
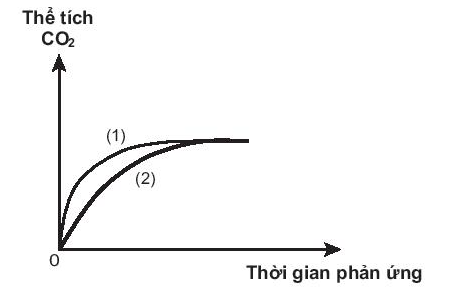
Bài 19.16 trang 56 SBT Hóa học 10: Thực hiện hai thí nghiệm của cùng một lượng CaCO3 với dung dịch HCl (dư) có nồng độ khác nhau. Thể tích khí CO2 thoát ra theo thời gian được ghi lại trên đồ thị sau:
Phản ứng nào đã dùng HCl với nồng độ cao hơn?
Lời giải
Đồ thị (1) cho thấy lượng CO2 thoát ra nhanh hơn.
⇒ Phản ứng (1) có tốc độ cao hơn.
⇒ Phản ứng (1) đã sử dụng nồng độ HCl cao hơn.
Bài 19.17 trang 56 SBT Hóa học 10: Cho các phản ứng hóa học sau:
Biết rằng tốc độ của phản ứng này tuân theo biểu thức của định luật tác dụng khối lượng.
a) Hãy viết biểu thức tốc độ phản ứng.
b) Tốc độ phản ứng tức thời tăng dần hay giảm dần theo thời gian?
Lời giải
a) Biểu thức tốc độ phản ứng:
b) Theo thời gian, nồng độ H2O2 giảm dần nên tốc độ phản ứng tức thời giảm dần.
Bài 19.18 trang 56 SBT Hóa học 10: Cách làm nào sau đây sẽ làm củ khoai tây nhanh chín nhất?
B. Hấp cách thủy trong nồi cơm
Lời giải
Đáp án đúng là: C
Nhiệt độ càng cao thì tốc độ phản ứng càng nhanh.
Nướng ở 180oC sẽ làm củ khoai nhanh chín nhất.
Bài 19.19 trang 56 SBT Hóa học 10: Các nhà khảo cổ thường tìm được xác các loài động thực vật thời tiền sử nguyên vẹn trong băng. Hãy giải thích tại sao băng lại giúp bảo quản xác động thực vật.
Lời giải
Nhiệt độ thấp, tốc độ phản ứng phân hủy xảy ra rất chậm.
⇒ Băng giúp bảo quản xác động thực vật.
Bài 19.20 trang 56 SBT Hóa học 10: NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp HNO3 và HCl có tỉ lệ mol 1 : 3). NOCl có tính oxi hóa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hóa học sau:
Tốc độ phản ứng ở 70oC là 2.10-7 mol/(L.s) và ở 80oC là 4,5.10-7 mol/(L.s).
a) Tính hệ số nhiệt độ γ của phản ứng.
b) Dự đoán tốc độ phản ứng ở 60oC.
Lời giải
a) Hệ số nhiệt độ:
b) Tốc độ phản ứng ở 60oC:
Bài 19.21 trang 56 SBT Hóa học 10: Khi thắng đường để làm caramen hoặc nước hàng, ta thường dùng đường kính chứ không dùng đường phèn. Giải thích.
Lời giải
Đường kính có kích thước hạt nhỏ nên diện tích bề mặt lớn, phản ứng nhiệt phân tạo ra nước hàng nhanh chóng. Đường phèn có kích thước hạt lớn nên diện tích bề mặt lớn, phản ứng nhiệt phân tạo ra nước hàng lâu hơn.
Bài 19.22 trang 57 SBT Hóa học 10: Khi dùng MnO2 làm xúc tác trong phản ứng phân hủy H2O2, tại sao ta cần dùng MnO2 ở dạng bột chứ không dùng ở dạng viên.
Lời giải
Dạng bột để tăng diện tích bề mặt tiếp xúc giữa xúc tác và H2O2 làm tăng tốc độ phản ứng.
Bài 19.23 trang 57 SBT Hóa học 10: Trong công nghiệp, vôi sống được sản xuất bằng cách nung đá vôi.
Phản ứng hóa học xảy ra như sau:
Khi nung, đá vôi cần phải được đập nhỏ nhưng không nên nghiền mịn đá vôi thành bột. Giải thích.
Lời giải
Đập nhỏ đá vôi để tăng diện tích bề mặt, tăng tốc độ phản ứng phân hủy. Tuy nhiên, nếu nghiền đá vôi thành bột mịn thì CO2 lại khó thoát ra khỏi khối chất rắn. Khi đó CO2 lại tác dụng với CaO ở nhiệt độ cao, tạo thành CaCO3:
CaO + CO2 → CaCO3
Vận dụng
Bài 19.24 trang 57 SBT Hóa học 10: Trong quá trình tổng hợp nitric acid, có giai đoạn đốt cháy NH3 bằng O2 có xúc tác. Phản ứng xảy ra trong pha khí như sau:
b) Tính tốc độ trung bình của phản ứng theo đơn vị mol/h
c) Tính số mol NH3 và O2 sau 2,5 giờ.
Lời giải
a) Biểu thức tính tốc độ phản ứng trung bình:
b) Trong bình kín, tỉ lệ về nồng độ cũng chính là tỉ lệ về số mol. Do đó, tốc độ phản ứng có thể tính thông qua công thức:
Ta có: = 0,024 mol.
Tốc độ trung bình của phản ứng:
c) Ta có: số mol NH3 ban đầu là 0,025; số mol O2 ban đầu là 0,03 mol.
⇒ Sau 2,5 giờ, số mol NH3 còn lại là 9.10-3 mol; số mol O2 còn lại là 0,01 mol.
Bài 19.25 trang 57 SBT Hóa học 10: Thực hiện phản ứng sau:
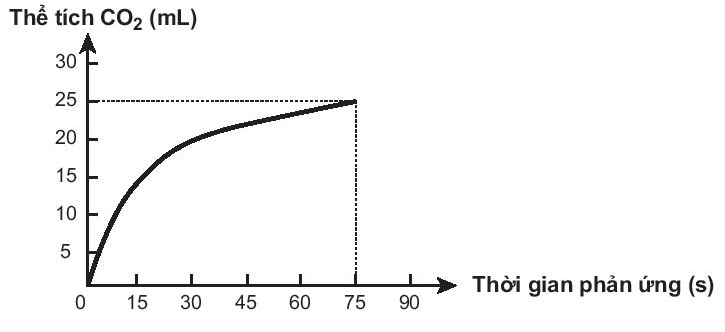
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Trong các phát biểu sau, phát biểu nào không đúng?
A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0.
B. Tốc độ phản ứng giảm dần theo thời gian.
C. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 0,33 mL/s.
D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
Lời giải
Đáp án đúng là: D
A. Phát biểu đúng. Ở 90oC phản ứng đã dừng lại nên tốc độ bằng 0.
B. Phát biểu đúng. Theo thời gian, nồng độ các chất tham gia giảm dần nên tốc độ phản ứng giảm dần.
C. Phát biểu đúng. Tốc độ trung bình của phản ứng từ thời điểm đầu đến 75 giây là:
D. Phát biểu sai. Theo thời gian, nồng độ các chất tham gia giảm dần nên tốc độ phản ứng giảm dần. Tốc độ trung bình của phản ứng trong 15 giây đầu sẽ lớn hơn tốc độ phản ứng trong 15 giây sau.
Bài 19.26 trang 58 SBT Hóa học 10: Thực hiện phản ứng sau:
H2SO4 + Na2S2O3 → Na2SO4 + SO2 + S + H2O
a) Vẽ đồ thị biểu diễn sự phụ thuộc thể tích khí SO2 vào thời gian phản ứng.
b) Thời điểm đầu, tốc độ phản ứng nhanh hay chậm?
c) Thời điểm kết thúc phản ứng, đồ thị có hình dạng như thế nào?
Lời giải
a) Đồ thị biểu diễn sự phụ thuộc thể tích khí SO2 vào thời gian phản ứng.
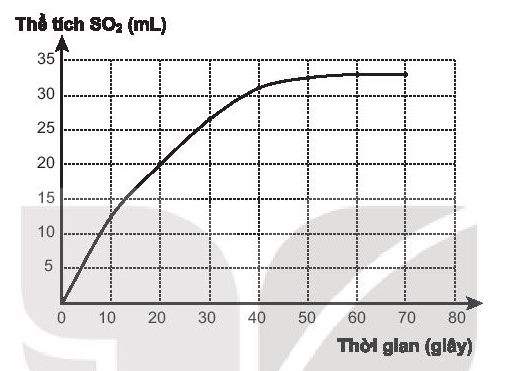
b) Thời điểm ban đầu: tốc độ phản ứng rất nhanh.
c) Thời điểm kết thúc phản ứng: đồ thị nằm ngang.
- Từ 0 ÷ 10 giây:
- Từ 10 ÷ 20 giây: ;
- Từ 20 ÷ 40 giây: .
Bài 19.27 trang 58 SBT Hóa học 10: Xét phản ứng sau:
2ClO2 + 2NaOH → NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau:
Hãy tính x và y trong biểu thức tốc độ phản ứng.
Lời giải
Thay giá trị của v và nồng độ ClO2, NaOH lần lượt vào biểu thức tốc độ phản ứng.
2.10-4 = k.(0,01)x.(0,01)y (1)
8.10-4 = k.(0,02)x.(0,01)y (2)
4.10-4 = k.(0,01)x.(0,02)y (3)
Lấy (1) chia cho (2) ta được:
⇔ ⇔ x = 2
Lấy (1) chia cho (3) ta được:
⇔ ⇔ y = 1
Vậy x = 2 và y = 1.
Bài 19.28 trang 59 SBT Hóa học 10: Hãy đề xuất một phương pháp thực nghiệm để nghiên cứu tốc độ các phản ứng sau đây. Trong đó chỉ rõ: đại lượng nào em sẽ đo; đồ thị theo dõi sự thay đổi của đại lượng đó theo thời gian có dạng thế nào.
a) Phản ứng xảy ra trong dung dịch:
CH3CH2Br + H2O → CH3CH2OH + HBr
b) Phản ứng xảy ra trong pha khí:
Lời giải
a) Đại lượng đo: nồng độ HBr thay đổi theo thời gian.
Đồ thị có dạng:
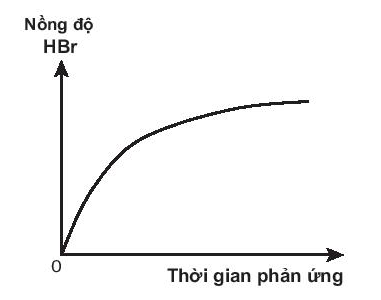
(Nồng độ dung dịch HBr tăng dần theo thời gian. Khi phản ứng kết thúc, đường này nằm ngang).
b) Đại lượng đo: áp suất tổng cộng thay đổi theo thời gian.
Đồ thị có dạng:
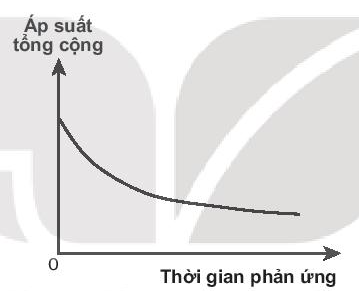
(Khi phản ứng xảy ra, số mol khí giảm nên áp suất tổng cộng giảm theo thời gian. Khi phản ứng kết thúc, đường này nằm ngang).
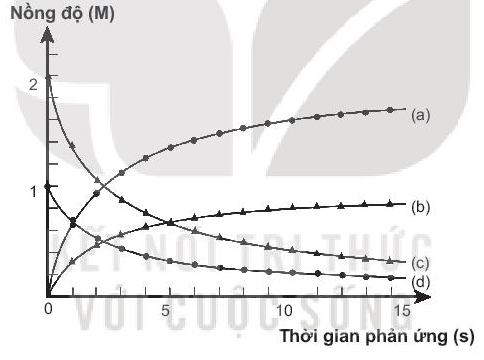
Bài 19.29 trang 59 SBT Hóa học 10: Thực hiện phản ứng:
Cho biết các đường (a), (b), (c), (d) tương ứng với sự biến đổi nồng độ các chất nào trong phương trình phản ứng trên. Giải thích.
Lời giải
Đường (a): nồng độ HCl thay đổi theo thời gian (nồng độ tăng dần, lượng tăng gấp đôi I2).
Đường (b): nồng độ I2 thay đổi theo thời gian (nồng độ tăng dần).
Đường (c): nồng độ ICl thay đổi theo thời gian (nồng độ giảm dần, lượng giảm gấp đôi H2).
Đường (d): nồng độ H2 thay đổi theo thời gian (nồng độ giảm dần).
Bài 19.30 trang 59 SBT Hóa học 10: Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất.
Phản ứng tổng hợp phosgen như sau: CO + Cl2 → COCl2
Biểu thức tốc độ phản ứng có dạng:
Tốc độ phản ứng thay đổi như nào nếu:
b) Giảm nồng độ Cl2 xuống 4 lần.
Lời giải
a) Tăng nồng độ CO lên 2 lần:
⇒ Tốc độ phản ứng tăng lên 2 lần.
b) Giảm nồng độ Cl2 xuống 4 lần:
⇒ Tốc độ phản ứng giảm 8 lần.
Bài 19.31 trang 60 SBT Hóa học 10: Cho phản ứng hóa học sau:
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Lời giải
a) = 7,5 mL/min.
b) ∆t = 2,5 min.
Bài 19.32 trang 60 SBT Hóa học 10: Khi nhiệt độ phòng là 25oC, cho 10 g đá vôi (dạng viên) vào cốc đựng 100 g dung dịch HCl loãng và nhanh chóng cho lên một cân điện tử. Đọc giá trị khối lượng cốc tại thời điểm ban đầu và sau 1 phút.
Lặp lại thí nghiệm khi nhiệt độ phòng là 35oC. Kết quả thí nghiệm được ghi trong bảng sau:
a) Tính hệ số nhiệt độ của phản ứng.
(Bỏ qua khối lượng nước bay hơi).
Lời giải
Khối lượng cốc giảm đi bằng khối lượng CO2 thoát ra sau phản ứng.
a) Tốc độ phản ứng ở 25oC là = 0,27 g/min.
Tốc độ phản ứng ở 35oC là = 0,57 g/min.
Hệ số nhiệt độ của phản ứng:
b) Tốc độ phản ứng ở 45oC là = 0,57.2,11 = 1,20 g/min.
Khối lượng cốc sau 1 phút là:
⇒ x = 235,40 – 1,20 = 234,20 (g).
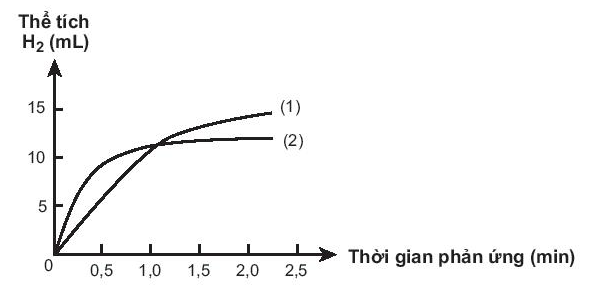
Cho biết đồ thị nào mô tả tốc độ thoát khí từ miếng sắt A, miếng sắt B. Giải thích.
Lời giải
Miếng iron có nhiều lỗ có diện tích bề mặt lớn hơn nên lúc đầu tốc độ phản ứng với HCl cao hơn. Đồ thị (2) mô tả tốc độ thoát khí từ miếng iron B. Đồ thị (1) mô tả tốc độ thoát khí từ miếng iron A.
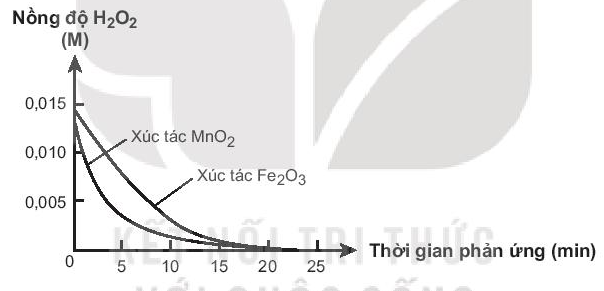
Bài 19.34 trang 61 SBT Hóa học 10: Xúc tác có hiệu quả cao là xúc tác làm tăng nhanh tốc độ phản ứng. Hai chất MnO2 và Fe2O3 đều có khả năng xúc tác cho phản ứng phân hủy H2O2. Đo nồng độ H2O2 theo thời gian, thu được đồ thị sau:
Cho biết xúc tác nào có hiệu quả hơn. Giải thích.
Lời giải
Xúc tác MnO2 có hiệu quả cao hơn vì đồ thị nồng độ H2O2 theo thời gian khi có mặt MnO2 dốc hơn khi có Fe2O3.
Bài 19.35 trang 61 SBT Hóa học 10: Khí oxygen và hydrogen có thể cùng tồn tại trong một bình kín ở điều kiện bình thường mà không nguy hiểm. Nhưng khi có tia lửa điện hoặc một ít bột kim loại được thêm vào bình thì lập tức có phản ứng mãnh liệt xảy ra và có thể gây nổ.
a) Tia lửa điện có phải chất xúc tác không? Giải thích.
b) Bột kim loại có phải chất xúc tác không? Giải thích.
Lời giải
a) Tia lửa điện chỉ cung cấp năng lượng, không là chất xúc tác. Phân tử H2 và O2 hấp thu năng lượng đó để có năng lượng cao hơn giá trị năng lượng hoạt hóa, xảy ra phản ứng.
Chú ý: Nhiệt tạo thành ra từ phản ứng H2 + O2 → 2H2O lại cung cấp năng lượng để phản ứng tiếp tục xảy ra.
b) Bột kim loại là chất xúc tác, làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra.