Giải Hoá 10 (Cánh diều) Bài 5: Lớp, phân lớp và cấu hình electron
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 5. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Video giải bài tập Hóa lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron
Lời giải:
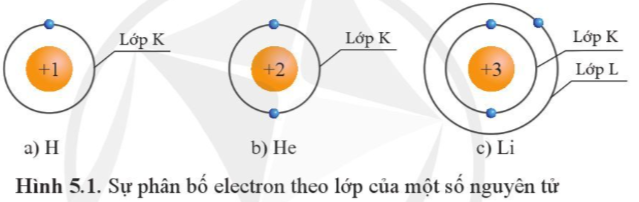
- Trong hình 5.1 có He (Z = 2) và Li (Z > 2), ta thấy lớp K của 2 nguyên tử này đều có 2 electron ⇒ số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là 2.
- Thứ tự phân bố electron vào lớp vỏ nguyên tử: Các electron sẽ được phân bố lần lượt vào các lớp theo chiều từ gần hạt nhân ra ngoài. Mỗi lớp có số electron đối đa xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ 2 có tối đa 8 electron,…
I. Lớp và phân lớp electron
1. Lớp electron
Lời giải:
Vì mỗi AO chứa tối đa 2 electron nên số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó.
Lời giải:
Số hiệu nguyên tử (Z) = số electron ⇒ Nitrogen có 7 electron được phân bố vào 2 lớp:
+ Lớp thứ nhất chứa 2 electron, phân bố vào 1 AO.
+ Lớp thứ hai chứa 5 electron, phân bố vào 4 AO.
Như vậy lớp ngoài cùng của nitrogen chứa 5 electron, phân bố vào 4 AO.
2. Phân lớp electron
Lời giải:
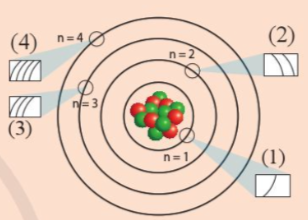
Các ô (1), (2), (3), (4) trong hình liên hệ với phân lớp electron.
Chú ý:
Lớp K, n =1 có 1 phân lớp,
Lớp L, n = 2 có 2 phân lớp,
Lớp M, n = 3 có 3 phân lớp,
Lớp N, n = 4 có 4 phân lớp.
Lời giải:
Lớp electron thứ tư (n = 4) có 4 phân lớp. Kí hiệu là 4s, 4p, 4d và 4f.
Câu hỏi 4 trang 27 Hóa học 10: Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf
Lời giải:
Vì mỗi AO chứa tối đa 2 electron nên ta có:
|
Phân lớp |
ns |
np |
nd |
nf |
|
Số AO |
1 |
3 |
5 |
7 |
|
Số electron tối đa (bão hòa) |
2 |
6 |
10 |
14 |
II. Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
Lời giải:
|
Số hiệu nguyên tử (Z) |
Cấu hình electron |
|
1 |
1s1 |
|
2 |
1s2 |
|
3 |
1s22s1 |
|
4 |
1s22s2 |
|
5 |
1s22s22p1 |
|
6 |
1s22s22p2 |
|
7 |
1s22s22p3 |
|
8 |
1s22s22p4 |
|
9 |
1s22s22p5 |
|
10 |
1s22s22p6 |
|
11 |
1s22s22p63s1 |
|
12 |
1s22s22p63s2 |
|
13 |
1s22s22p63s23p1 |
|
14 |
1s22s22p63s23p2 |
|
15 |
1s22s22p63s23p3 |
|
16 |
1s22s22p63s23p4 |
|
17 |
1s22s22p63s23p5 |
|
18 |
1s22s22p63s23p6 |
|
19 |
1s22s22p63s23p64s1 |
|
20 |
1s22s22p63s23p64s2 |
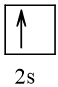
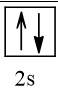
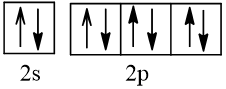
2. Biểu diễn cấu hình electron theo ô orbital
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Lời giải:
|
Số hiệu nguyên tử (Z) |
Cấu hình electron |
Tính chất hóa học cơ bản |
|
1 |
1s1 |
Tính phi kim |
|
2 |
1s2 |
Khí hiếm (tính trơ) |
|
3 |
1s22s1 |
Tính kim loại |
|
4 |
1s22s2 |
Tính kim loại |
|
5 |
1s22s22p1 |
Tính phi kim |
|
6 |
1s22s22p2 |
Tính phi kim |
|
7 |
1s22s22p3 |
Tính phi kim |
|
8 |
1s22s22p4 |
Tính phi kim |
|
9 |
1s22s22p5 |
Tính phi kim |
|
10 |
1s22s22p6 |
Khí hiếm (tính trơ) |
|
11 |
1s22s22p63s1 |
Tính kim loại |
|
12 |
1s22s22p63s2 |
Tính kim loại |
|
13 |
1s22s22p63s23p1 |
Tính kim loại |
|
14 |
1s22s22p63s23p2 |
Tính phi kim |
|
15 |
1s22s22p63s23p3 |
Tính phi kim |
|
16 |
1s22s22p63s23p4 |
Tính phi kim |
|
17 |
1s22s22p63s23p5 |
Tính phi kim |
|
18 |
1s22s22p63s23p6 |
Khí hiếm (Tính trơ) |
|
19 |
1s22s22p63s23p64s1 |
Tính kim loại |
|
20 |
1s22s22p63s23p64s2 |
Tính kim loại |
Bài tập (trang 30)
Bài 1 trang 30 Hóa học 10: Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(*) Ngoại trừ nguyên tử H có năng lượng các phân lớp trong một lớp là bằng nhau.
Lời giải:
(a) Sai. Các orbital s đều có dạng hình cầu.
(b) Đúng.
(c) Sai. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(d) Đúng.
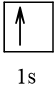
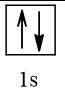
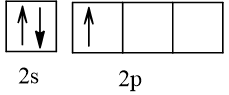
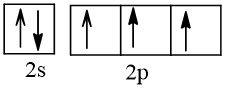
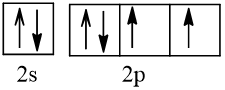
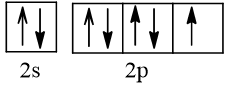
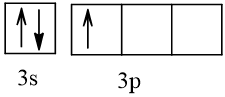
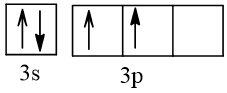
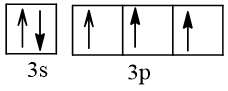
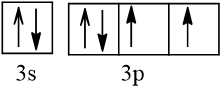
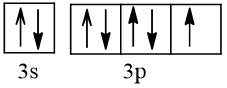
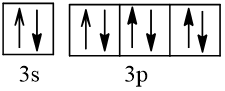
Bài 2 trang 30 Hóa học 10: Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Lời giải:
Cấu hình electron theo orbital của nguyên tố X có thể là
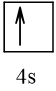
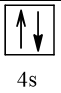
Vậy X có thể là Z = 3 (Li) hoặc Z = 5 (Bo) hoặc Z = 9 (F).
Bài 3* trang 30 Hóa học 10: Cấu hình electron của các ion được thiết lập bằng cách nhận hoặc nhường electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của ion Na+ và ion Cl-.
Trả lời:
a) Cấu hình electron của Na (Z = 11): 1s22s22p63s1. Nguyên tử Na nhường 1 electron để được ion Na+.
⇒ Cấu hình electron của Na+ là 1s22s22p6.
Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5. Nguyên tử Cl nhận 1 electron để được ion Cl‑.
⇒ Cấu hình electron của Cl- là 1s22s22p63s23p6
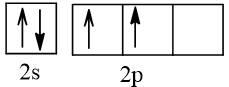
b) Cấu hình theo orbital lớp ngoài cùng của nguyên tử Cl
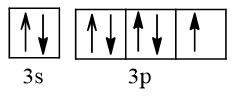
Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp 3p của Cl. AO đó là AO chứa 1 electron.