Giải Hoá 10 (Cánh diều) Bài 16: Tốc độ phản ứng hóa học
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 16: Tốc độ phản ứng hóa học sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 16. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 16: Tốc độ phản ứng hóa học
Video giải bài tập Hóa lớp 10 Bài 16: Tốc độ phản ứng hóa học
Lời giải:
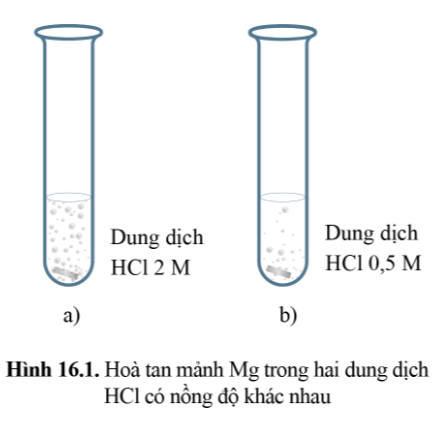
Mảnh Mg ở thí nghiệm (a) sẽ tan hết trước, do ở thí nghiệm (a) nồng độ HCl là 2M lớn hơn nồng độ HCl ở thí nghiệm (b).
I. Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
1. Khái niệm tốc độ phản ứng
Lời giải:
Trong cùng một khoảng thời gian lượng HCl và Mg bị mất đi ở thí nghiệm (a) là nhanh hơn so với thí nghiệm (b).
⇒ Lượng MgCl2 tạo thành ở thí nghiệm (a) cũng tăng lên nhanh hơn.
Coi thể tích của dung dịch là không đổi trong suốt quá trình của phản ứng
⇒ Nồng độ của MgCl2 ở thí nghiệm (a) tăng lên nhanh hơn.
Lời giải:
Tốc độ của phản ứng (1) ở (thí nghiệm (a)) là nhanh hơn so với tốc độ của phản ứng ở (thí nghiệm (b)).
2. Tốc độ trung bình của phản ứng
Lời giải:
Tốc độ trung bình của phản ứng:
ΔC = C2 – C1 ; Δt = t2 – t1
Trong đó C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1 và t2.
Các chất tham gia có nồng độ giảm theo thời gian ⇒ C2 < C1 ⇒ ΔC < 0
Vậy để tốc độ phản ứng nhận giá trị dương cần phải thêm dấu trừ trong biểu thức (3) khi tính tốc độ trung bình của phản ứng theo các chất tham gia phản ứng.
Lời giải:
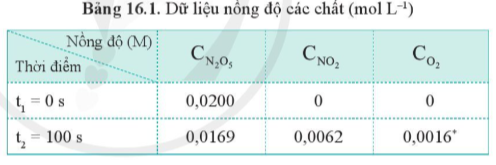
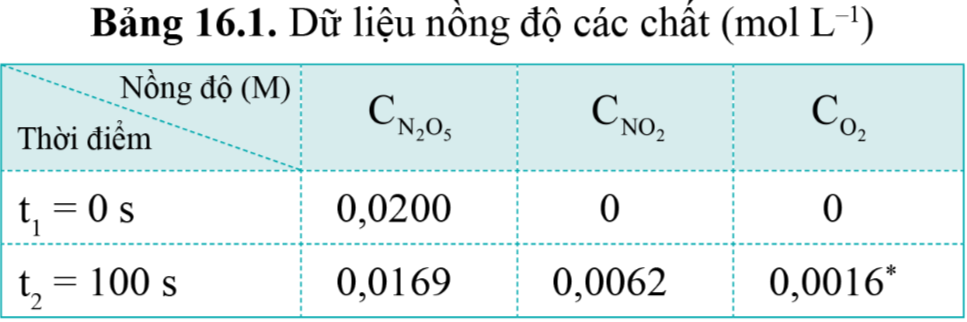
Nồng độ ban đầu của O2 (C1) là 0, nồng độ sau 100s (C2) là 0,0016M.
Δt = 100 s – 0 s = 100 s. Vậy tốc độ trung bình của phản ứng trong 100 s đầu tiên là:
= 1,6.10-5 (M.s-1).
Lời giải:
Từ bảng 6.1, không thể tính được tốc độ trung bình của phản ứng sau 50 giây vì chưa biết nồng độ của các chất (C2) tại t2 = 50 s
Lời giải:
Sắp xếp tốc độ các phản ứng sau theo chiều tăng dần:
(2) phản ứng gỉ sắt < (1) phản ứng than cháy trong không khí < (3) phản ứng nổ của khí bình gas.
II. Định luật tác dụng khối lượng
Lời giải:
Hiện tượng:
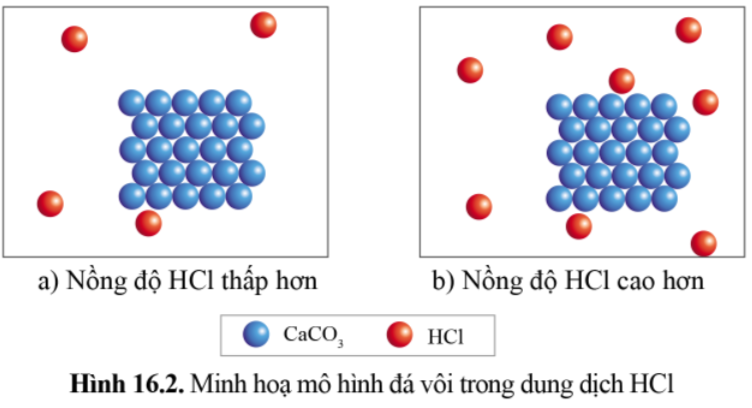
Mẩu đá vôi ở ống nghiệm (b) tan nhanh hơn mẩu đá vôi ở ống nghiệm (a); đồng thời khí thoát ra ở ống nghiệm (b) cũng nhanh hơn khí thoát ra ở ống nghiệm (a).
Phương trình hóa học của phản ứng:
CaCO3 (s) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
Nhận xét:
Nồng độ HCl càng lớn thì tốc độ của phản ứng càng lớn.
Lời giải:
Bơm N2 hoặc CO2 vào túi đựng thực phẩm trước khi đóng gói nhằm mục đích đẩy bớt oxygen ra ngoài (làm giảm nồng độ oxygen trong túi) ⇒ Giảm tốc độ phản ứng oxi hóa thực phẩm của oxygen cũng như sự hoạt động của vi khuẩn ⇒ Hạn chế sự ôi thiu thực phẩm.
Lời giải:
Biểu thức (5) v = k.
Nếu nồng độ của chất A và B đều bằng 1M thì ta có: v = k.1.1 hay v = k
Như vậy hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng.
Lời giải:
Phản ứng (6): H2 (g) + I2 (g) → 2HI (g)
Tốc độ của phản ứng (6): v = k.
Nếu nồng độ H2 tăng gấp đôi thì v’ = k. = 2.v
⇒ Nếu nồng độ H2 tăng gấp đôi thì tốc độ của phản ứng tăng gấp đôi.
III. Các yếu tố ảnh hưởng đến tốc độ phản ứng, hệ số nhiệt độ vant’t hoff (γ)
1. Ảnh hưởng của nồng độ
Lời giải:
Theo định luật tác dụng khối lượng, tốc độ của phản ứng H2(g) với I2(g) là:
v = k.
Khi nồng độ của H2(g) cũng như I2(g) đều tăng lên gấp đôi ta có:
v’ = k. = 4.v
Vậy tốc độ của phản ứng tăng lên 4 lần.
Vận dụng 3 trang 93 Hóa học 10: Hãy giải thích các hiện tượng dưới đây.
a) Khi ở nơi đông người trong không gian kín, ta cảm thấy khó thở và phải thở nhanh hơn.
b) Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.
c) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí (chứa 21% thể tích oxygen).
Lời giải:
a) Khi ở nơi đông người trong không gian kín, ta cảm thấy khó thở và phải thở nhanh hơn.
Vì: Oxygen duy trì sự hô hấp, khi ở nơi đông người trong không gian kín nồng độ oxygen giảm đi nhanh vì phải cung cấp cho nhiều người ⇒ Con người bị thiếu oxygen nên cảm thấy khó thở và phải thở nhanh hơn để lấy oxygen.
b) Oxygen duy trì sự cháy mà trong bình khí oxygen nguyên chất, nồng độ oxygen lớn hơn ngoài không khí.
⇒ Tốc độ phản ứng cháy xảy ra nhanh hơn, mãnh liệt hơn.
⇒ Tàn đóm đỏ bùng cháy.
c) Bệnh nhân suy hô hấp cần thở oxygen thay vì không khí do: bệnh nhân suy hô hấp khó khăn trong việc tự thở, dẫn đến thiếu oxygen cung cấp cho hoạt động của cơ thể. Trong bình khí nén oxygen, nồng độ oxygen cao hơn nồng độ oxygen có trong không khí giúp bệnh nhân thở dễ dàng hơn, cung cấp đủ oxygen cho các tế bào, giúp duy trì sự sống.
2. Ảnh hưởng của áp suất
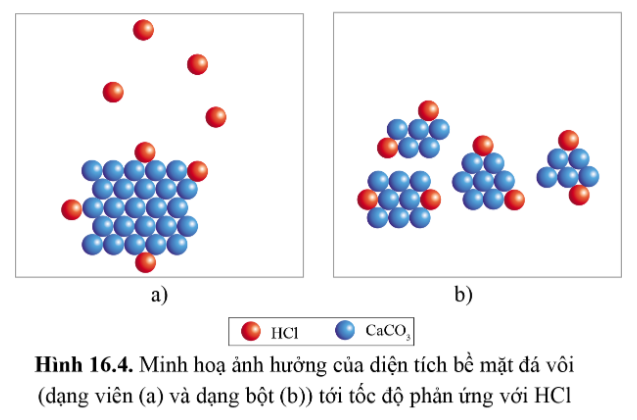
3. Ảnh hưởng của diện tích bề mặt
Lời giải:
Hiện tượng: Mẩu đá vôi B (đã được tán nhỏ thành bột) tan trong dung dịch HCl nhanh hơn mẩu đá vôi A, đồng thời khí thoát ra ở ống nghiệm chứa mẩu B (đã được tán nhỏ thành bột) cũng nhanh hơn.
Phương trình hóa học của phản ứng:
CaCO3 (s) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
Nhận xét: Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn.
Lời giải:
Khi diện tích bề mặt đá vôi tăng lên (đá vôi dạng bột) thì số lượng va chạm của CaCO3 với HCl trong cùng một đơn vị thời gian sẽ lớn hơn, số lượng va chạm hiệu quả cũng cao hơn, từ đó tốc độ phản ứng nhanh hơn.
Vận dụng 4 trang 94 Hóa học 10: Giải thích vì sao thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn.
Lời giải:
Thanh củi chẻ nhỏ hơn thì diện tích bề mặt tiếp xúc của củi với oxygen không khí sẽ lớn hơn làm cho củi sẽ cháy nhanh hơn.
4. Ảnh hưởng của nhiệt độ
Lời giải:
Hiện tượng: Ở ống nghiệm được đun nóng bằng đèn cồn đinh sắt tan nhanh hơn, đồng thời khí thoát ra nhanh hơn.
Phương trình hóa học của phản ứng:
Fe(s) + H2SO4 (aq) → FeSO4 (aq) + H2(g)
Nhận xét: Nhiệt độ càng cao, tốc độ phản ứng càng lớn.
Câu hỏi 8 trang 95 Hóa học 10: Vì sao đinh sắt trong thí nghiệm bên phải được tẩy sạch gỉ và dầu mỡ?
Lời giải:
Vì khi đinh sắt bị bao quanh bởi lớp gỉ và dầu mỡ (lẫn tạp chất) sẽ làm kết quả thí nghiệm không chính xác.
Lời giải:
Dựa vào tốc độ thoát khí nhanh hay chậm để so sánh tốc độ phản ứng trong hai thí nghiệm này.
Lời giải:
⇔ = 23 = 8
Vậy với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20oC lên 50oC thì tốc độ phản ứng tăng 8 lần.
5. Ảnh hưởng của chất xúc tác
Lời giải:
- Rót khoảng 2 ml nước oxi già (dung dịch H2O2 3%) vào một ống nghiệm.
Hiện tượng: Xuất hiện lăn tăn bọt khí.
Nhận xét: Dung dịch H2O2 3% ở điều kiện bình thường phân hủy rất chậm tạo bọt khí O2 thoát ra. Theo phương trình:
2H2O2(aq) → O2(g) + 2H2O(l)
- Thêm một lượng nhỏ bột MnO2 (màu đen, dùng làm chất xúc tác) vào ống nghiệm.
Hiện tượng: Bọt khí thoát ra mãnh liệt, khi kết thúc thí nghiệm màu đen của MnO2 ban đầu vẫn giữ nguyên.
Nhận xét: Phản ứng xảy ra nhanh hơn do thêm xúc tác MnO2, sau phản ứng MnO2 không bị biến đổi.
2H2O2(aq) O2(g) + 2H2O(l)
Kết luận: Chất xúc tác MnO2 làm tăng tốc độ phân hủy H2O2.
Lời giải:
Enzyme amylase và lipase có trong nước bọt là chất xúc tác đẩy nhanh quá trình tiêu hóa tinh bột và chất béo.
Khi nhai kĩ thức ăn được chia nhỏ hơn nhằm tăng diện tích tiếp xúc giữa thức ăn với các enzyme, khiến các phản ứng trong quá trình tiêu hóa chất béo và tinh bột xảy ra nhanh hơn, hiệu quả hơn.
Bài tập (trang 98)
Lời giải:
Đáp án đúng là: C
Áp dụng mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ ta có:
Trong đó giá trị γ = 2 – 4
Với γ = 2 ⇒ = 4
Vậy tốc độ quá trình thủy phân collagen thành gelatin sẽ tăng lên ít nhất 4 lần khi sử dụng nồi áp suất thay cho nồi thường.
Lời giải:
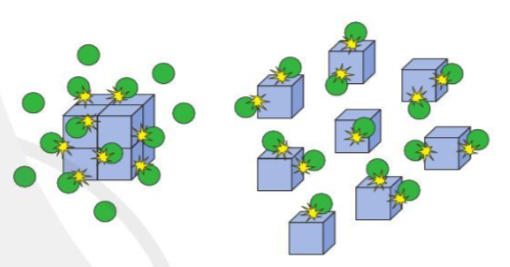
Hình ảnh bên minh họa ảnh hưởng của diện tích tiếp xúc tới tốc độ phản ứng.
Giả sử khối lập phương là chất X, quả cầu màu xanh là chất Y.
Khi chất X được chia nhỏ, số va chạm của chất X và chất Y (trong cùng một đơn vị thời gian) sẽ lớn hơn, số va chạm hiệu quả cũng tăng lên, từ đó tốc độ phản ứng tăng.
Lời giải:
Phương trình hóa học của phản ứng:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Để làm tăng tốc độ điều chế khí H2 ta có thể:
- Tăng nồng độ dung dịch HCl.
- Đun nóng ống nghiệm chứa hỗn hợp Fe và HCl
- Dùng sắt bột và khuấy nhẹ trong quá trình phản ứng.
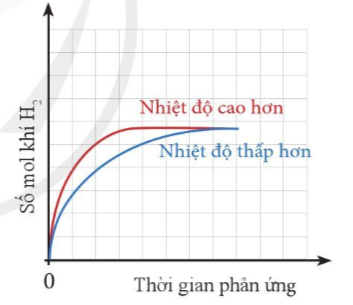
Bài 4* trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên.
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh.
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Lời giải:
a) Đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh do: Nhiệt độ càng cao, tốc độ phản ứng càng lớn, khí thoát ra càng nhiều.
b) Sau một thời gian, hai đồ thị lại chụm lại với nhau do phản ứng đã dừng lại (một hoặc cả hai các chất tham gia phản ứng hết). Do cùng lượng kim loại và H2SO4 cùng thể tích, nồng độ nên lượng khí thu được là như nhau ở cả 2 trường hợp.
Bài 5* trang 98 Hóa học 10: Phản ứng A → sản phẩm được thực hiện trong bình kín. Nồng độ của A tại các thời điểm t = 0; t = 1 phút; t = 2 phút lần lượt là 0,1563 M; 0,1496 M; 0,1431 M.
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và từ phút thứ nhất tới hết phút thứ hai.
b) Vì sao hai giá trị tốc độ tính được không bằng nhau.
Lời giải:
a) Tốc độ trung bình của phản ứng trong phút thứ nhất là
= = 1,12.10-4 (M.s-1)
Tốc độ trung bình của phản ứng từ phút thứ nhất tới hết phút thứ hai là
= = 1,08.10-4 (M.s-1)
b) Đa số các phản ứng hóa học có nồng độ giảm dần theo thời gian.
Nồng độ của chất phản ứng càng lớn thì tốc độ phản ứng càng lớn. Càng về sau nồng độ của chất A càng giảm nên tốc độ của phản ứng cũng giảm dần.