Giải Hoá 10 (Cánh diều) Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Hoá lớp 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá 10 Bài 6. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Video giải bài tập Hóa lớp 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Lời giải:
Cấu hình electron của các nguyên tử nguyên tố:
Mg (Z = 12): 1s22s22p63s2
Li (Z = 3): 1s22s1
P (Z = 15): 1s22s22p63s23p3
F (Z = 9): 1s22s22p5
⇒ Có Li và F có 2 lớp electron. Vậy các nguyên tố thuộc chu kì 2 là:
Li (Z = 3), F (Z = 9).
I. Lịch sử phát minh
Câu hỏi 1 trang 32 Hóa học 10: Mendeleev sắp xếp 9 nguyên tố như bảng 6.1 theo những nguyên tắc nào?
Bảng 6.1. Cách sắp xếp 9 nguyên tố hóa học theo khối lượng nguyên tử của Mendeleev
|
Sr = 87,6 |
Ba = 137 |
Lời giải:
Mendeleev sắp xếp các nguyên tố theo chiều tăng dần khối lượng nguyên tử và nhận thấy các nguyên tố trong một hàng có tính chất tương tự nhau: dãy halogen (Cl, Br và I), kim loại kiềm (K, Rb, Cs) và kim loại kiềm thổ (Ca, Sr, Ba).
Lời giải:

Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn năm 1869 của Mendeleev:
Các nguyên tố có tính chất hóa học tương tự nhau được sắp xếp vào cùng một hàng.
Theo hàng dọc, các nguyên tố được sắp xếp theo thứ tự tăng dần khối lượng nguyên tử
Luyện tập 1 trang 32 Hóa học 10: Trong hình 6.1, Mendeleev có ghi: Au = 197? và Bi = 210? Theo em ý nghĩa của dấu hỏi chấm ở đây là gì?
Lời giải:
Dấu hỏi chấm biểu thị dự đoán của Mendeleev về những nguyên tố này.
II. Nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học
Câu hỏi 3 trang 33 Hóa học 10: Quan sát bảng tuần hoàn ở Phụ lục 1 và cho biết trong bảng có bao nhiêu hàng, bao nhiêu cột và bao nhiêu nguyên tố hóa học.
Lời giải:
Quan sát bảng tuần hoàn xác định được, bảng tuần hoàn có 7 hàng, 18 cột và 118 nguyên tố hóa học.
III. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
Câu hỏi 4 trang 34 Hóa học 10: Hãy cho biết những thông tin thu được từ ô nguyên tố vanadium.
Lời giải:
Từ ô nguyên tố vanadium ta biết:
+ Số hiệu nguyên tử (Z) : 23
+ Kí hiệu hóa học: V
+ Tên nguyên tố: Vanadium
+ Nguyên tử khối trung bình: 50,942.
2. Chu kì
Lời giải:
Oxygen (kí hiệu là O) là nguyên tố phổ biến nhất trong vỏ Trái Đất.
Quan sát bảng tuần hoàn xác định được, oxygen nằm ở ô số 8 trong bảng tuần hoàn.
Lời giải:
Nguyên tố được bổ sung vào muối ăn để giảm nguy cơ bướu cổ là iodine (kí hiệu là I).
Iodine thuộc chu kì 5 trong bảng tuần hoàn.
3. Nhóm
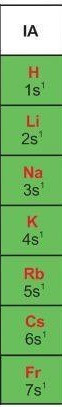
Câu hỏi 5 trang 34 Hóa học 10: Sử dụng bảng tuần hoàn (Phụ lục 1) và cho biết các nguyên tố nhóm IA có đặc điểm về cấu hình electron tương tự nhau như thế nào.
Lời giải:
Các nguyên tố nhóm IA đều có 1 electron ở lớp ngoài cùng. Do đó, cấu hình electron lớp ngoài cùng dạng ns1
IV. Liên hệ giữa cấu hình electron nguyên tử với vị trí của nguyên tố trong bảng tuần hoàn
Câu hỏi 6 trang 35 Hóa học 10: Viết cấu hình electron nguyên tử Na. Cho biết trong bảng tuần hoàn, Na nằm ở ô số 11, chu kì 3, nhóm IA. Nêu mối liên hệ giữa số hiệu nguyên tử, số lớp electron, số electron lớp ngoài cùng và vị trí của Na trong bảng tuần hoàn.
Lời giải:
Cấu hình electron nguyên tử Na là 1s22s22p63s1.
Na có:
Số hiệu nguyên tử = số thứ tự ô nguyên tố trong bảng tuần hoàn = 11
Số lớp electron = số thứ tự chu kì = 3
Số electron lớp ngoài cùng = số thứ tự nhóm = 1.
Luyện tập 2 trang 35 Hóa học 10: Từ cấu hình electron của Fe là 1s22s22p63s23p63d64s2. Hãy xác định vị trí của Fe trong bảng tuần hoàn.
Lời giải:
Từ cấu hình electron của Fe ta thấy, Fe thuộc:
+ Ô số 26 trong bảng tuần hoàn (do Z = số electron = 26)
+ Chu kì 4 (do có 4 lớp electron)
+ Nhóm VIIIB (do cấu hình electron phân lớp ngoài cùng và sát ngoài cùng là 3d64s2).
Lưu ý: Các nguyên tố nhóm B có cấu hình electron phân lớp ngoài cùng và sát ngoài cùng dạng (n – 1)d1-10ns1-2.
V. Phân loại nguyên tố hóa học
1. Dựa theo cấu hình electron
Luyện tập 3 trang 36 Hóa học 10: Dựa theo cấu hình electron, hãy phân loại các nguyên tố có số hiệu nguyên tử lần lượt là 11, 20, 29.
Lời giải:
+ Nguyên tố có Z = 11 có cấu hình electron là: 1s22s22p63s1 ⇒ Là nguyên tố s.
+ Nguyên tố có Z = 20 có cấu hình electron là: 1s22s22p63s23p64s2 ⇒ Là nguyên tố s
+ Nguyên tố có Z = 29 có cấu hình electron là: 1s22s22p63s23p6 3d104s1 ⇒ thuộc nhóm B ⇒ Là nguyên tố d.
2. Dựa theo tính chất hóa học
Lời giải:
Hiện nay có khoảng hơn 90 nguyên tố kim loại, gần 20 nguyên tố phi kim và 7 nguyên tố khí hiếm.
Vận dụng 3 trang 37 Hóa học 10: Hãy thu thập thông tin về các vấn đề sau:
2. Mendeleev đã tiên đoán chi tiết về ba nguyên tố nào? Nêu cụ thể những tiên đoán đó.
3. Sưu tầm hình ảnh các bảng tuần hoàn các nguyên tố hóa học khác nhau.
Lời giải:
1. Ngoài Mendeleev, một số nhà khoa học cũng có đóng góp vào việc xây dựng bảng và quy luật tuần hoàn, ở những mức độ khác nhau như:
- Năm 1789, A. Lavoisier (La-voa-die, người Pháp) đã thực hiện xếp 33 nguyên tố hóa học thành các nhóm chất khí, kim loại, phi kim và “đất”.
- Năm 1829, J, Ư, Dobereiner (Đô-be-rai-nơ, người Đức) phân loại các nguyên tố thành các nhóm có tính chất hóa học giống nhau. Ví dụ: Lithium, sodium và potassium là nhóm các kim loại mềm, dễ phản ứng.
- Năm 1866, J Newlands (Niu-lan, người Anh) đã xếp các nguyên tố hóa học theo chiều tăng khối lượng nguyên tử thành các octave (quãng tám), trong đó nguyên tố thứ tám lặp lại tính chất của nguyên tố đầu tiên.
- Năm 1869, ngoài Mendeleev thì J.L. Meyer (May-ơ, người Đức) cũng sắp xếp các nguyên tố theo chiều tăng khối lượng nguyên tử và các hàng và cột, bắt đầu mỗi hàng (bảng của Mendeleev) hoặc cột mới (bảng của Mayer) khi các tính chất của nguyên tố bắt đầu lặp lại.
2. Nhờ định luật tuần hoàn của mình, 3 nguyên tố Sc, Ga và Ge đã được Mendeleev tiên đoán khá tỉ mỉ về tính chất của đơn chất và hợp chất của chúng.
- Năm 1871, Mendeleev đã dự đoán một nguyên tố hóa học cùng “nhóm của nhôm (aluminium)”, có nguyên tử lượng (nguyên tử khối) khoảng 68, tỉ trọng là 5,9 – 6,0.
Đến năm 1875, một nhà khoa học người Pháp đã tạo ra được một nguyên tố mới trong quặng kẽm (zinc) trắng và đặt tên là Galium (Ga). Sau một thời gian nghiên cứu chính xác, nhà khoa học người Pháp này đã kết luận các chỉ số của nguyên tố Ga đúng như những dự đoán của Mendeleev.
- Năm 1871, Mendeleev đã dự đoán một nguyên tố hóa học nằm trong “nhóm của Bo”.
Đến năm 1879, tại Thụy Điển người ta đã sử dụng phương pháp phân tích quang phổ và tìm thấy một nguyên tố mới trong các khoáng chất euxenit và gadolinit. Nguyên tố này được đặt tên là Scandium (Sc), nó có những tính chất hóa học phù hợp với dự đoán của Mendeleev.
- Năm 1871, germanium (Ge) là một trong các nguyên tố mà Mendeleev dự đoán tồn tại như là nguyên tố tương tự nhưng còn thiếu của nhóm silicon (silic) (Mendeleev gọi nó là "eka-silicon"). Sự tồn tại của nguyên tố này được Clemens Winkler (nhà hóa học người Đức) chứng minh năm 1886.
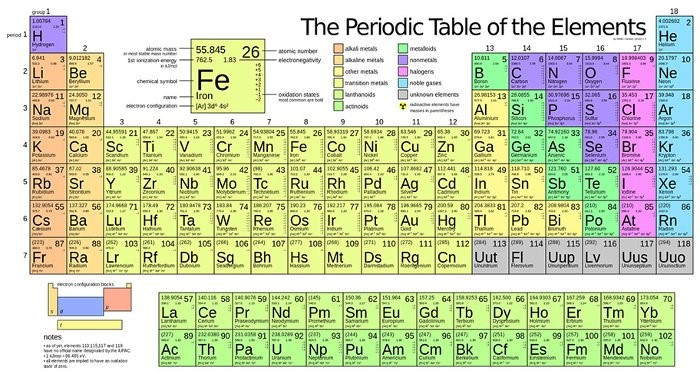
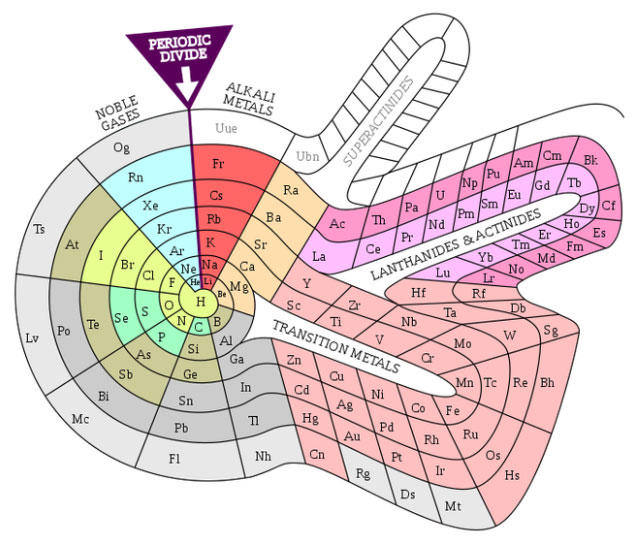
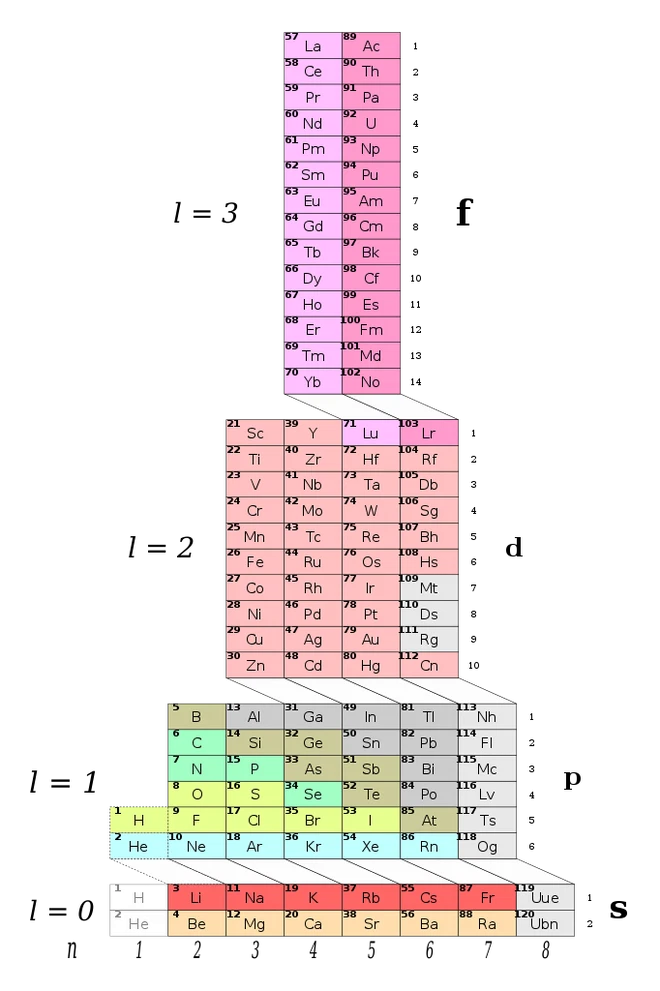
3. Một số hình ảnh các bảng tuần hoàn các nguyên tố hóa học khác nhau:
Bài tập (trang 37)
Bài 1 trang 37 Hóa học 10: Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về
Lời giải:
Đáp án đúng là A
Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về khối lượng nguyên tử.
Bài 2 trang 37 Hóa học 10: Nguyên tố X và Y có số hiệu nguyên tử lần lượt là 21 và 35. Viết cấu hình electron, từ đó xác định vị trí của X, Y (số thứ tự của ô nguyên tố, chu kì và nhóm) trong bảng tuần hoàn.
Lời giải:
- Cấu hình electron của nguyên tố X (Z = 21) là: 1s22s22p63s23p6 3d14s2. X thuộc:
+ Ô thứ 21 (do số hiệu nguyên tử là 21)
+ Chu kì 4 (do có 4 lớp electron)
+ Nhóm IIIB (do cấu hình electron lớp ngoài cùng và sát ngoài cùng là 3d14s2 ).
- Cấu hình electron của nguyên tố Y (Z = 35) là: 1s22s22p63s23p6 3d104s24p5. Y thuộc:
+ Ô thứ 35 (do số hiệu nguyên tử là 35)
+ Chu kì 4 (do có 4 lớp electron)
+ Nhóm VIIA (do có 7 electron lớp ngoài cùng, nguyên tố p).
Bài 3 trang 37 Hóa học 10: Bằng cách viết cấu hình electron, hãy xác định trong các nguyên tố thuộc chu kì 2 trong bảng tuần hoàn, những nguyên tố nào thuộc khối s, những nguyên tố nào thuộc khối p.
Lời giải:
Chu kì 2 gồm các nguyên tố có số hiệu nguyên tử từ 3 đến 10.
|
Số hiệu nguyên tử (Z) |
Cấu hình electron |
Phân loại nguyên tố |
|
3 |
1s22s1 |
Nguyên tố s |
|
4 |
1s22s2 |
Nguyên tố s |
|
5 |
1s22s22p1 |
Nguyên tố p |
|
6 |
1s22s22p2 |
Nguyên tố p |
|
7 |
1s22s22p3 |
Nguyên tố p |
|
8 |
1s22s22p4 |
Nguyên tố p |
|
9 |
1s22s22p5 |
Nguyên tố p |
|
10 |
1s22s22p6 |
Nguyên tố p |
Vậy trong chu kì 2 có 2 nguyên tố Li (Z = 3); Be (Z = 4) thuộc khối nguyên tố s; 6 nguyên tố còn lại: B, C, N, O, F, Ne thuộc khối nguyên tố p.



