Giải Khoa học tự nhiên 7 (Cánh diều) Bài 1: Nguyên tử
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Khoa học tự nhiên lớp 7 Bài 1: Nguyên tử sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Khoa học tự nhiên 7 Bài 1. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên 7 Bài 1: Nguyên tử
Video giải Khoa học tự nhiên 7 Bài 1: Nguyên tử
Trả lời:
Nguyên tử là hạt nhỏ nhất vì nó không chia nhỏ hơn được nữa.
I. Nguyên tử là gì?
Câu hỏi 1 trang 10 KHTN lớp 7: Hãy cho biết nguyên tử là gì.
Trả lời:
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Ví dụ:
+ Đồng tiền vàng được cấu tạo từ các nguyên tử vàng (gold);
+ Khí oxygen được cấu tạo nên từ các nguyên tử oxygen.
Câu hỏi 2 trang 10 KHTN lớp 7: Kể tên hai chất có chứa nguyên tử oxygen
Trả lời:
Hai chất có chứa nguyên tử oxygen là đường ăn, nước.
Cụ thể:
- Đường ăn được tạo nên từ các nguyên tử carbon, oxygen và hydrogen.
- Nước được tạo nên từ các nguyên tử hydrogen và oxygen.
II. Cấu tạo nguyên tử
Câu hỏi 3 trang 11 KHTN lớp 7: Trong các hạt cấu tạo nên nguyên tử:
b) Hạt nào mang điện tích dương?
Trả lời:
Trong các hạt cấu tạo nên nguyên tử:
a) Hạt electron (kí hiệu là e) mang điện tích âm.
b) Hạt proton (kí hiệu là p) mang điện tích dương.
c) Hạt neutron (kí hiệu là n) không mang điện.
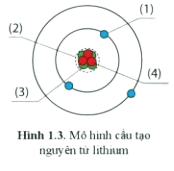
Trả lời:
(1) Electron
(2) Hạt nhân
(3) Proton
(4) Neutron
Luyện tập 2 trang 11 KHTN lớp 7: Hoàn thành thông tin trong bảng sau:
|
Nguyên tử |
Số proton |
Số neutron |
Số electron
|
Điện tích hạt nhân |
|
Hydrogen |
1 |
0 |
? |
? |
|
Carbon |
? |
6 |
6 |
? |
|
Phosphorus |
15 |
16 |
? |
? |
Trả lời:
Vận dụng các kiến thức:
+ Trong nguyên tử, số electron bằng số proton.
+ Điện tích hạt nhân nguyên tử bằng tổng điện tích các proton. Ta có bảng:
|
Nguyên tử |
Số proton |
Số neutron |
Số electron |
Điện tích hạt nhân |
|
Hydrogen |
1 |
0 |
1 |
+1 |
|
Carbon |
6 |
6 |
6 |
+6 |
|
Phosphorus |
15 |
16 |
15 |
+15 |
Trả lời:
Số đơn vị điện tích hạt nhân = Số proton = Số electron = 13
Số hạt trong hạt nhân nguyên tử = số proton + số neutron
⇒ 27 = 13 + số neutron
⇒ số neutron = 27 - 13 = 14.
Aluminium có 13 proton ⇒ Điện tích hạt nhân của aluminium: +13.
Tìm hiểu thêm trang 12 KHTN lớp 7: Điện tích của nguyên tử helium bằng bao nhiêu?
Trả lời:
Nguyên tử sulfur (lưu huỳnh) có: Số electron = số proton = 16
+) 16 electron, mỗi electron có điện tích -1
⇒ Tổng điện tích âm: -16
+) 16 proton, mỗi proton có điện tích +1
⇒ Tổng điện tích dương: +16
Tổng điện tích trong nguyên tử sulfur (lưu huỳnh) bằng 0. Nên nguyên tử sulfur (lưu huỳnh) trung hòa về điện.
III. Sự chuyển động của electron trong nguyên tử
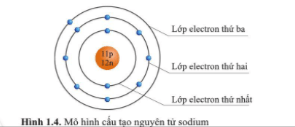
Trả lời:
Nguyên tử sodium có 3 lớp electron.
- Lớp thứ nhất (lớp trong cùng) có 2 electron.
- Lớp thứ hai có 8 electron.
- Lớp thứ ba có 1 electron.
Trả lời:
- Đối với nguyên tử nitrogen có 7 e được sắp xếp vào 2 lớp.
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ 2 có 5 electron.
⇒ Nguyên tử nitrogen có 5 electron ở lớp ngoài cùng.
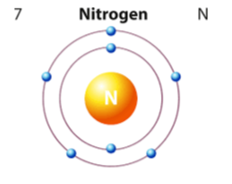
Mô tả các lớp electron của nitrogen
- Đối với nguyên tử silicon có 14 e được sắp xếp vào 3 lớp.
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba có 4 electron.
⇒ Nguyên tử silicon có 4 electron lớp ngoài cùng.
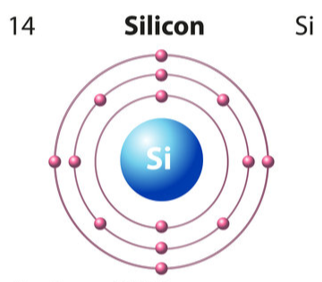
Mô tả các lớp electron của silicon
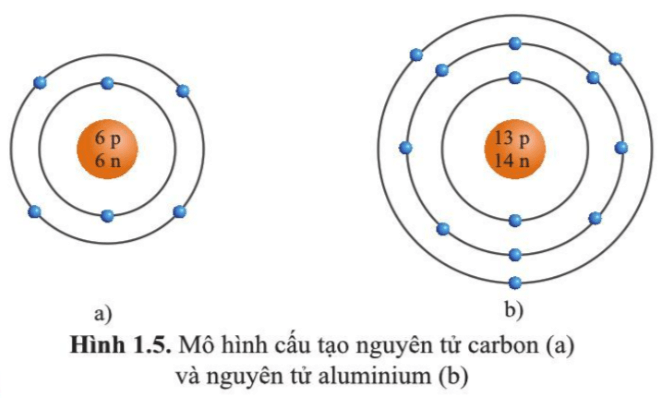
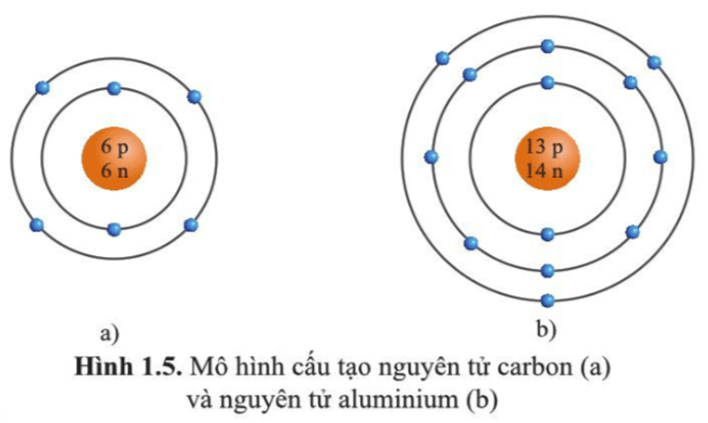
Trả lời:
Hình 1.5 a)
Trong nguyên tử carbon có 2 lớp electron.
- Lớp thứ nhất (lớp trong cùng) có 2 electron.
- Lớp thứ hai có 4 electron.
Hình 1.5 b)
Trong nguyên tử aluminium có 3 lớp electron.
- Lớp thứ nhất (lớp trong cùng) có 2 electron.
- Lớp thứ hai có 8 electron.
- Lớp thứ ba có 3 electron.
IV. Khối lượng nguyên tử
Câu hỏi 5 trang 13 KHTN lớp 7: Trong ba loại hạt tạo nên nguyên tử, hạt nào có khối lượng nhỏ nhất?
Trả lời:
Proton và neutron đều có khối lượng xấp xỉ bằng 1 amu.
Khối lượng của electron là 0,00055 amu.
⇒ Hạt electron có khối lượng nhỏ nhất.
Câu hỏi 6 trang 13 KHTN lớp 7: Khối lượng của nguyên tử được tính bằng đơn vị nào?
Trả lời:
Khối lượng của nguyên tử được tính bằng đơn vị khối lượng nguyên tử, kí hiệu là amu (atomic mass unit).
1 amu = 1,6605.10-24 g.
Luyện tập 6 trang 13 KHTN lớp 7: Quan sát hình 1.5 hãy cho biết:
a) Số proton, neutron, electron trong mỗi nguyên tử carbon và aluminium.
b) Khối lượng nguyên tử của carbon và aluminium.
Trả lời:
a) Trong nguyên tử carbon có 6 proton; 6 neutron; 6 electron.
Trong nguyên tử aluminium có 13 proton; 14 neutron; 13 electron.
b) Chú ý: Khối lượng của electron nhỏ hơn nhiều lần so với khối lượng của proton và neutron nên có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân.
- Trong nguyên tử carbon có 6 proton; 6 neutron nên khối lượng của một nguyên tử carbon là: 6.1 + 6.1 = 12 (amu)
- Trong nguyên tử aluminium có 13 proton; 14 neutron nên khối lượng của một nguyên tử aluminium là: 13.1 + 14.1 = 27 (amu)
Luyện tập 7 trang 14 KHTN lớp 7: Hoàn thành thông tin còn thiếu trong bảng sau:
|
Hạt trong nguyên tử |
Khối lượng (amu) |
Điện tích |
Vị trí trong nguyên tử |
|
Proton |
? |
+1 |
? |
|
Neutron |
? |
? |
Hạt nhân |
|
Electron |
0,00055 |
? |
? |
Trả lời:
|
Hạt trong nguyên tử |
Khối lượng (amu) |
Điện tích |
Vị trí trong nguyên tử |
|
Proton |
1 |
+1 |
Hạt nhân |
|
Neutron |
1 |
0 |
Hạt nhân |
|
Electron |
0,00055 |
-1 |
Vỏ nguyên tử |
a) Hãy ghi chú thích tên các hạt tương ứng trong hình vẽ mô tả cấu tạo nguyên tử carbon.
b) Em hãy tìm hiểu ý nghĩa của các kí hiệu HB, 2B và 6B được ghi trên một số loại bút chì.
Trả lời:
a) Trong nguyên tử carbon có: 6 electron (màu xanh nước biển), 6 proton (màu đỏ), 6 neutron (màu xanh lá cây).
b)
Một thang phân loại có ghi trên thân bút chì bao gồm từ: 9B, 8B, 7B, 6B, 5B, 4B, 3B, 2B, B, HB, F, H, 2H, 3H, 4H, 5H, 6H, 8H, 9H.
Trong đó:
H là viết tắt của Hard (cứng)
B viết tắt cho từ Black
F là Fine có thể gọt rất nhọn mà không làm gãy đầu chì (loại bút này rất hiếm gặp).
Trong dãy trên, đi từ trái qua phải độ cứng tăng dần đồng thời độ đen càng ít đi (nhạt dần). Các bút chì black (B) là màu đen đậm nhất tỉ lệ nghịch với độ cứng, độ cứng càng nhiều thì độ đen càng ít đi.
Vậy bút chì 9B là đậm nhất thuần màu đen và mềm nhất, 7B thì nhạt hơn, 5B thì nhạt hơn nữa, còn 9H thì cứng nhất bởi vậy nên nét bút cũng nhạt nhất trong thang phân loại.
Phần lớn những cây bút chì thông dụng thường ở mức HB (hard = black) nghĩa là trung bình về độ cứng và màu đen, không quá cứng và cũng không quá đậm.
Bài giảng Khoa học tự nhiên lớp 7 Cánh diều