Giải Khoa học tự nhiên 7 (Cánh diều) Bài 5: Giới thiệu về liên kết hóa học
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Khoa học tự nhiên lớp 7 Bài 5: Giới thiệu về liên kết hóa học sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Khoa học tự nhiên 7 Bài 5. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên 7 Bài 5: Giới thiệu về liên kết hóa học
Bài giảng Khoa học tự nhiên 7 Bài 5: Giới thiệu về liên kết hóa học
Trả lời:
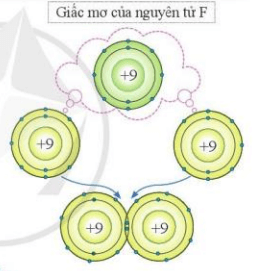
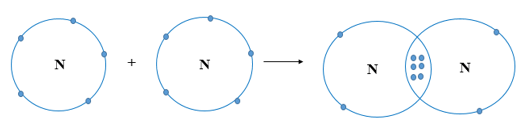
Các nguyên tử của nguyên tố khí hiếm tồn tại độc lập trong điều kiện thường do lớp vỏ ngoài cùng của các nguyên tử khí hiếm bền vững với 8 electron (riêng He có 2 electron).
Nguyên tử của các nguyên tố khác có lớp vỏ ngoài cùng kém bền, có xu hướng tạo ra lớp vỏ tương tự khí hiếm khi liên kết với nguyên tử khác.
Liên kết giữa các nguyên tử được hình thành bằng cách:
+ Cho – nhận electron
+ Góp chung electron.
I. Đặc điểm cấu tạo vỏ nguyên tử khí hiếm
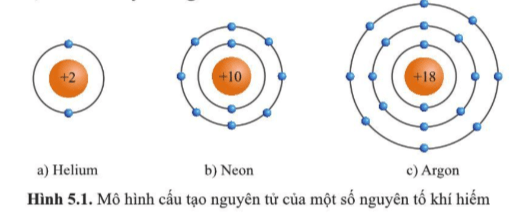
Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron).
Cụ thể:
Hình 5.1a) nguyên tử helium có 2 electron ở lớp ngoài cùng.
Hình 5.1b) nguyên tử neon có 8 electron ở lớp ngoài cùng.
Hình 5.1c) nguyên tử argon có 8 electron ở lớp ngoài cùng.
Trả lời:
+ Helium ở trạng thái lỏng được sử dụng để làm mát nam châm siêu dẫn trong các loại máy chụp cộng hưởng từ. Tránh sinh nhiệt quá cao gây nguy hiểm.
+ Helium nhẹ hơn không khí nên thường được dùng để bơm vào khí cầu hay bóng bay.
Bình khí helium bơm bóng bay
+ Helium được sử dụng làm môi trường truyền nhiệt trong lò phản ứng hạt nhân thế hệ mới.
+ Khí helium được sử dụng để phát hiện rò rỉ. Bởi vì helium có kích thước phân tử nhỏ nhất do đó khí helium đi dễ dàng qua những chỗ rò rỉ nhỏ nhất.
+ Helium được dùng để sản xuất chất bán dẫn, sợi cáp quang, sử dụng trong một số ổ đĩa cứng, kính thiên văn,...
II. Liên kết ion
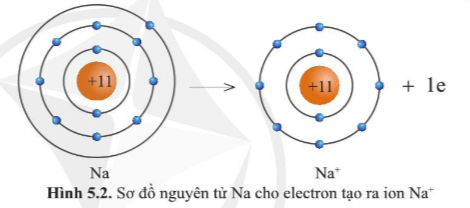
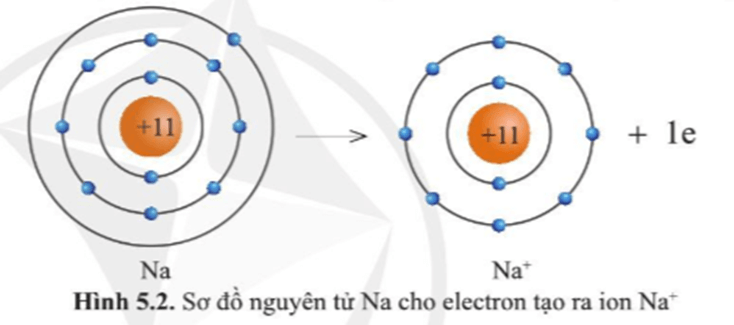
Lớp vỏ của ion Na+ có 10 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm neon.
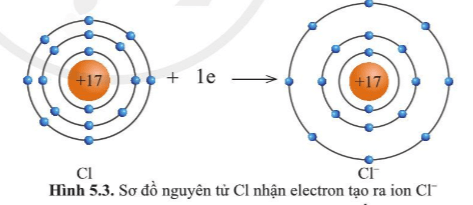
Lớp vỏ của ion Cl- có 18 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm argon.
Trả lời:
Quan sát hình ảnh ta so sánh được như sau:
+ Ion Na+ ít hơn nguyên tử Na 1 eletron.
+ Ion Na+ ít hơn nguyên tử Na một lớp electron.
Trả lời:
Khi K kết hợp với F để tạo thành phân tử potassium fluoride:
+ Nguyên tử K cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là K+.
+ Nguyên tử F nhận 1 electron từ nguyên tử K trở thành ion mang một điện tích âm, kí hiệu là F-.
Các ion K+ và F- hút nhau tạo thành liên kết trong phân tử potassium fluoride.
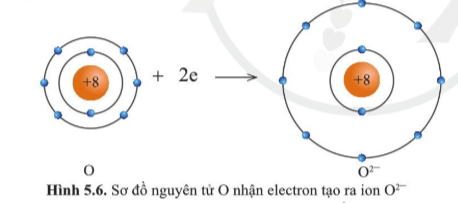
Quan sát hình ảnh rút ra các nhận xét:
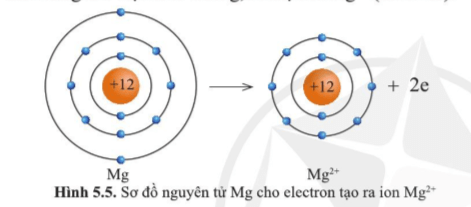
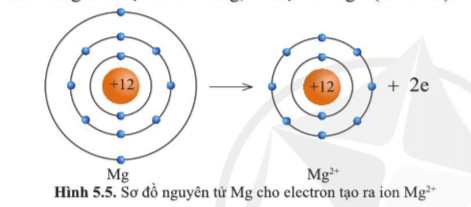
Ion Mg2+ lớp vỏ có 10 electron tương tự như khí hiếm neon.
Ion O2- lớp vỏ có 10 electron tương tự như khí hiếm neon.
Trả lời:
Quan sát hình ảnh xác định được:
Ion Mg2+ có ít hơn nguyên tử Mg 2 electron.
Ion Mg2+ có ít hơn nguyên tử Mg một lớp electron.
Theo sơ đồ trên ta thấy nguyên tử Mg cho đi 2 electron lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Mg2+.
Trả lời:
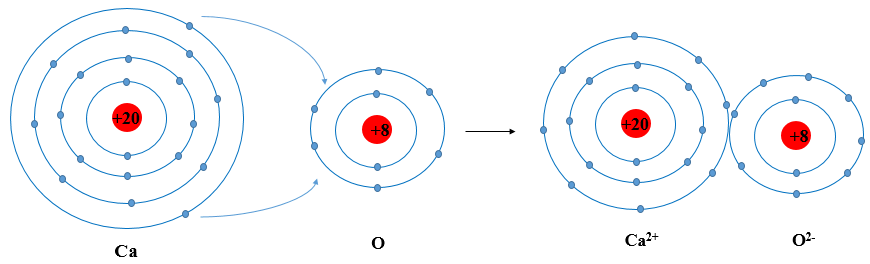
Khi Ca kết hợp với O tạo thành phân tử calcium oxide sẽ diễn ra sự cho và nhận electron giữa hai nguyên tử như sau:
+ Nguyên tử Ca cho đi 2 electron lớp ngoài cùng trở thành ion mang hai điện tích dương, kí hiệu là Ca2+.
+ Nguyên tử O nhận 2 electron từ nguyên tử Ca tạo thành ion mang điện tích âm kí hiệu là O2-.
Các ion Ca2+ và O2- hút nhau tạo thành liên kết trong phân tử calcium oxide.
Trả lời:
Ở điều kiện thường, potassium chloride là chất rắn vì:
Khi nguyên tử K (kim loại điển hình) kết hợp với nguyên tử Cl (phi kim điển hình) thì kim loại K sẽ cho electron tạo thành ion dương, nguyên tử Cl sẽ nhận electron tạo thành ion âm. Các ion dương và ion âm hút nhau tạo ra hợp chất ion là potassium chloride.
Các hợp chất ion đều là chất rắn ở điều kiện thường.
potassium chloride
III. Liên kết cộng hóa trị
Trả lời:
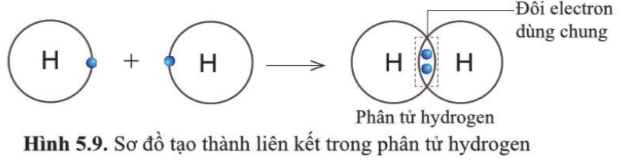
Phân tử hydrogen gồm hai nguyên tử H, mỗi nguyên tử H có 2 electron ở lớp vỏ.
Giống với lớp vỏ của khí hiếm helium
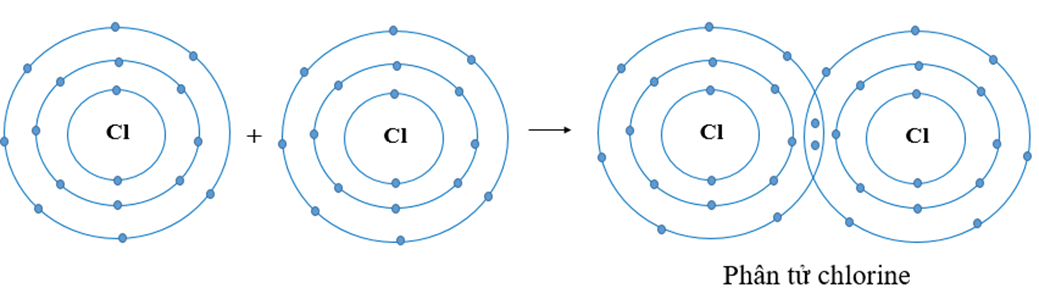
Luyện tập 4 trang 36 KHTN lớp 7: Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine.
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm?
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine.
Trả lời:
a)
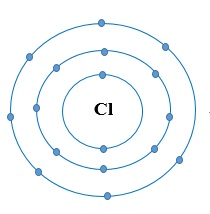
Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
b) Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
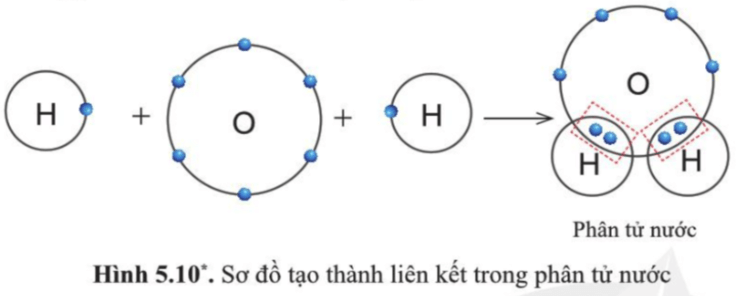
Trong phân tử nước, nguyên tử O có 8 electron lớp ngoài cùng tương tự như khí hiếm.
Mỗi nguyên tử H có 2 electron lớp ngoài cùng tương tự như khí hiếm helium
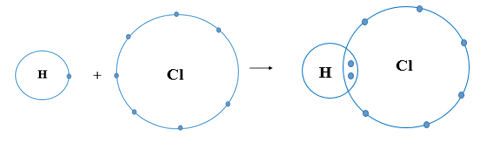
Trả lời:
Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi nguyên tử H kết hợp với nguyên tử Cl, nguyên tử Cl góp 1 electron, nguyên tử H góp 1 electron. Như vậy giữa nguyên tử H và nguyên tử Cl có 1 đôi electron dùng chung. Hạt nhân nguyên tử H và Cl cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử hydrogen chloride.
Chú ý: Trong mô hình cấu tạo vỏ nguyên tử ở các phần liên kết cộng hóa trị, chỉ cần biểu diễn lớp electron ngoài cùng.
Trả lời:
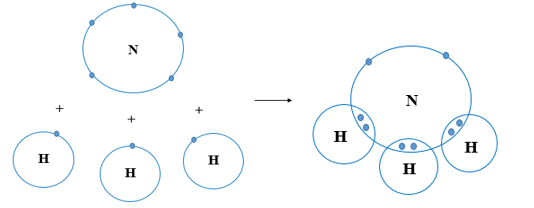
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi N kết hợp với H, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
Trả lời:
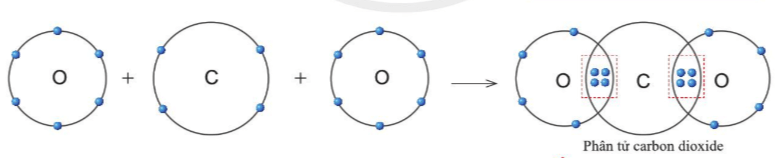
Quan sát hình 5.11. xác định được trong phân tử khí carbonic, nguyên tử C có 4 electron dùng chung với nguyên tử O (mỗi nguyên tử O góp 2 electron).
Trả lời:
Nguyên tử N có 7 electron, trong đó có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
Khi hai nguyên tử N liên kết với nhau, mỗi nguyên tử góp chung 3 electron để tạo ra 3 cặp electron dùng chung. Hạt nhân của hai nguyên tử N cùng hút các đôi electron dùng chung và liên kết với nhau tạo thành phân tử nitrogen.
Vận dụng trang 38 KHTN lớp 7: Hãy giải thích các hiện tượng sau:
a) Nước tinh khiết hầu như không dẫn điện, nhưng nước biển lại dẫn được điện.
Trả lời:
a) Nước tinh khiết chỉ gồm các phân tử H2O không có lẫn phân tử khác. Lại có H2O là chất cộng hóa trị nên dẫn điện kém.
Nước biển là một hỗn hợp, ngoài H2O còn có các muối, phổ biến nhất là sodium chloride (NaCl). Sodium chloride là chất ion nên khi NaCl tan trong nước tạo dung dịch dẫn được điện.
Thí nghiệm thử tính dẫn điện của nước cất và nước biển
b) Khi cho đường ăn vào chảo rồi đun nóng sẽ thấy đường ăn nhanh chóng chuyển từ thể rắn sang thể lỏng, làm như vậy với muối ăn thấy muối ăn vẫn ở thể rắn.
Giải thích:
Đường ăn là hợp chất cộng hóa trị nên có nhiệt độ nóng chảy thấp. Muối ăn là hợp chất ion nên có nhiệt độ nóng chảy cao.
Muối ăn và đường sau khi đun
Câu hỏi 9 trang 38 KHTN lớp 7: So sánh một số tính chất chung của chất cộng hóa trị với chất ion.
Trả lời:
|
Tính chất |
Chất ion |
Chất cộng hóa trị |
|
Trạng thái (ở điều kiện thường) |
Thể rắn |
Cả ba thể (rắn, lỏng, khí) |
|
Nhiệt độ sôi, nhiệt độ nóng chảy |
Cao |
Thấp |
|
Dẫn điện |
Tan trong nước tạo dung dịch dẫn được điện |
Nhiều chất không dẫn điện (đường ăn, ethanol,…) |