Giải Khoa học tự nhiên 7 (Cánh diều) Bài tập Chủ đề 1, 2 trang 26, 27
Hoidap.vietjack.com trân trọng giới thiệu: lời giải bài tập Khoa học tự nhiên lớp 7 Bài tập Chủ đề 1, 2 trang 26, 27 sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Khoa học tự nhiên 7 Bài tập Chủ đề 1, 2. Mời các bạn đón xem:
Giải bài tập Khoa học tự nhiên 7 Bài tập Chủ đề 1, 2
Video giải Khoa học tự nhiên 7 Bài tập Chủ đề 1, 2
Trả lời:
|
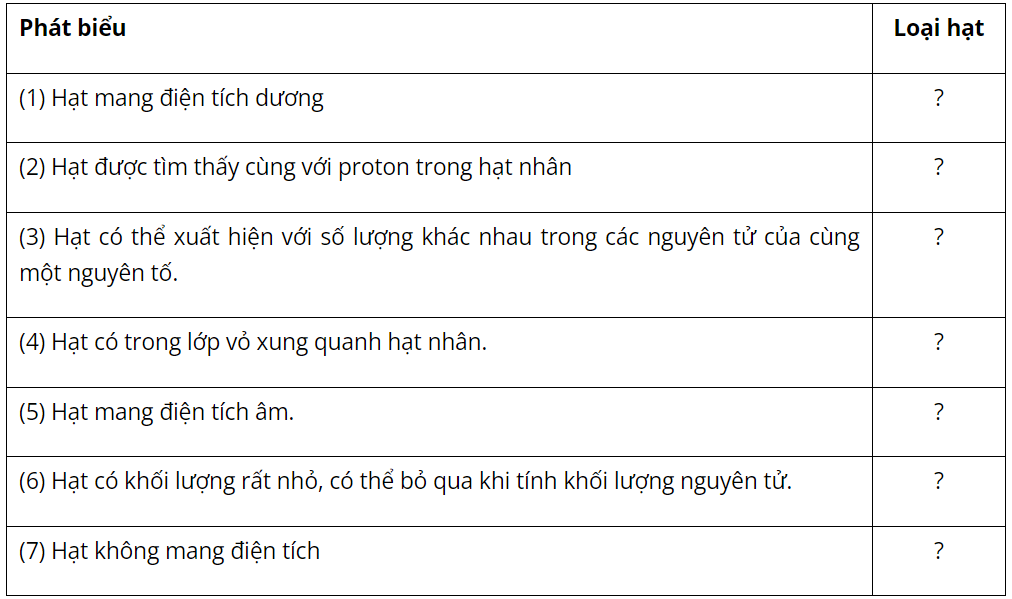
Phát biểu |
Loại hạt |
|
(1) Hạt mang điện tích dương |
proton |
|
(2) Hạt được tìm thấy cùng với proton trong hạt nhân |
neutron |
|
(3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố. |
neutron |
|
(4) Hạt có trong lớp vỏ xung quanh hạt nhân. |
electron |
|
(5) Hạt mang điện tích âm. |
electron |
|
(6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử. |
electron |
|
(7) Hạt không mang điện tích |
neutron |
Câu hỏi 2 trang 26 KHTN lớp 7: Điền thông tin thích hợp vào chỗ … trong mỗi câu sau:
a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt …(?)…
b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là …(?)…
c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là …(?)…
e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là …(?)…
Trả lời:
a) Hạt nhân của nguyên tử được cấu tạo bởi các hạt proton và neutron.
b) Một nguyên tử có 17 proton trong hạt nhân, số electron chuyển động quanh hạt nhân là 17.
c) Một nguyên tử có 10 electron, số proton trong hạt nhân của nguyên tử đó là 10.
d) Khối lượng nguyên tử nguyên tố X bằng 19 amu, số electron của nguyên tử đó là 9. Số neutron của nguyên tử X là 10.
e) Một nguyên tử có 3 proton, 4 neutron và 3 electron. Khối lượng của nguyên tử đó là 7 amu.
Trả lời:
Hydrogen (H), helium (He), carbon (C), nitrogen (N), oxygen (O), sodium (Na).
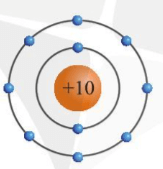
Câu hỏi 4 trang 26 KHTN lớp 7: Mô hình sắp xếp electron trong nguyên tử của nguyên tố X như sau:
a) Trong nguyên tử X có bao nhiêu electron và được sắp xếp thành mấy lớp.
b) Hãy cho biết tên nguyên tố X.
c) Gọi tên một nguyên tố khác mà nguyên tử của nó có cùng số lớp electron với nguyên tử nguyên tố X.
Trả lời:
a) Nguyên tử X có 10 electron và được sắp xếp thành 2 lớp:
+ Lớp thứ nhất có 2 electron;
+ Lớp thứ hai có 8 electron.
b) Nguyên tố X có tên là neon (kí hiệu hóa học là Ne)
c) Số lớp electron = số thứ tự chu kì.
Nguyên tử Ne có 2 lớp electron ⇒ thuộc chu kì 2.
⇒ Các nguyên tử của nguyên tố: Lithium (Li), beryllium (Be), boron (B), carbon (C), nitrogen (N), oxygen (O), fluorine (F) đều thuộc chu kì 2 ⇒ đều có 2 lớp electron giống như nguyên tử nguyên tố neon (Ne)
Câu hỏi 5 trang 27 KHTN lớp 7: Hoàn thành những thông tin còn thiếu trong bảng sau:
|
Tên nguyên tố |
Kí hiệu hóa học |
Nguyên tử của nguyên tố |
|||
|
Số proton |
Số neutron |
Số electron |
Khối lượng nguyên tử (amu) |
||
|
? |
? |
? |
10 |
9 |
? |
|
Sulfur |
? |
? |
? |
16 |
32 |
|
? |
? |
12 |
? |
? |
24 |
|
? |
? |
1 |
? |
? |
2 |
|
? |
? |
? |
? |
11 |
23 |
Trả lời:
|
Tên nguyên tố |
Kí hiệu hóa học |
Nguyên tử của nguyên tố |
|||
|
Số proton |
Số neutron |
Số electron |
Khối lượng nguyên tử (amu) |
||
|
Fluorine |
F |
9 |
10 |
9 |
19 |
|
Sulfur |
S |
16 |
16 |
16 |
32 |
|
Magnesium |
Mg |
12 |
12 |
12 |
24 |
|
Hydrogen |
H |
1 |
1 |
1 |
2 |
|
Sodium |
Na |
11 |
12 |
11 |
23 |
a) Tính khối lượng của nguyên tử X và nguyên tử Y.
b) Nguyên tử X và nguyên tử Y có thuộc cùng một nguyên tố hóa học không? Vì sao?
Trả lời:
Lưu ý:
- Vì khối lượng của electron rất nhỏ so với khối lượng của proton và neutron nên một cách gần đúng: Khối lượng nguyên tử = khối lượng proton + khối lượng neutron (amu)
a) Khối lượng nguyên tử X = 6.1 + 6.1 = 12 amu
Khối lượng nguyên tử Y = 6.1 + 8.1 = 14 amu
b) Nguyên tử X và nguyên tử Y có thuộc cùng một nguyên tố hóa học vì có cùng số proton trong hạt nhân.
a) Hãy sắp xếp các nguyên tố trên theo chiều tăng dần điện tích hạt nhân.
b) Cho biết các nguyên tố trên là kim loại, phi kim hay khí hiếm.
Trả lời:
Sử dụng bảng tuần hoàn, xác định được:
a) Các nguyên tố trên được sắp xếp chiều tăng dần điện tích hạt nhân như sau:
F (Z = 9), Ne (Z = 10), Na (Z = 11), Mg (Z = 12), S (Z = 16), Ca (Z = 20)
b) Các nguyên tố kim loại: Na, Mg, Ca.
Các nguyên tố phi kim: F, S.
Nguyên tố khí hiếm: Ne.
|
Số hiệu nguyên tử |
Tên nguyên tố |
Kí hiệu hóa học |
Khối lượng nguyên tử |
Chu kì |
Nhóm |
Kim loại, phi kim hay khí hiếm |
|
12 |
? |
? |
? |
? |
? |
? |
|
15 |
? |
? |
? |
? |
? |
? |
|
18 |
? |
? |
? |
? |
? |
? |
Trả lời:
|
Số hiệu nguyên tử |
Tên nguyên tố |
Kí hiệu hóa học |
Khối lượng nguyên tử |
Chu kì |
Nhóm |
Kim loại, phi kim hay khí hiếm |
|
12 |
Magnesium |
Mg |
24 |
3 |
IIA |
Kim loại |
|
15 |
Phosphorus |
P |
31 |
3 |
VA |
Phi kim |
|
18 |
Argon |
Ar |
40 |
3 |
VIIIA |
Khí hiếm |
Trả lời:
- Nguyên tử của nguyên tố M có 2 electron ở lớp ngoài cùng ⇒ thuộc nhóm IIA.
- Có 3 lớp electron ⇒ thuộc chu kì 3.
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba (lớp ngoài cùng) có 2 electron.
⇒ Nguyên tử của nguyên tố M có 12 electron
⇒ Thuộc ô số 12 trong bảng tuần hoàn.
M là kim loại.