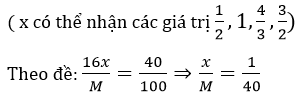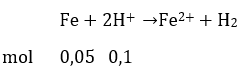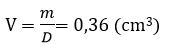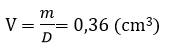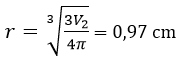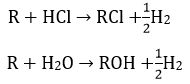Top 50 trắc nghiệm Hoá học lớp 12 Bài 16 (có đáp án)
Bộ câu hỏi trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 12 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 12
Bài 1: Cho các nguyên tố: 11Na, 12Mg, 13Al, 19K. Dãy các nguyên tố nào sau đây được xếp theo chiều tính kim loại tăng dần:
A. Al, Mg, Na, K .
B. Mg, Al, Na, K.
C. K, Na, Mg, Al.
D. Na, K, Mg,Al.
Đáp án: A
Bài 2: Kim loại M phản ứng với oxi để tạo thành oxit. Khối lượng oxi đã phản ứng bằng 40% khối lượng kim loại đã dùng. Kim loại M là:
A. Na B. Ca C.Fe D.Al
Đáp án: B
Đặt công thức của oxit kim loại là MOx
Lập bảng
| X | 1/2 | 1 | 4/3 | 3/2 |
| M | 20 | 40 | 53,33 | 60 |
Vậy kim loại M là Ca, oxit tạo thành là CaO
Bài 3: Một viên bi sắt có đường kính 2cm ngập trong một cốc chứa 100ml axit có pH = 0, phản ứng xảy ra hoàn toàn. Bán kính viên bi sắt sau phản ứng (coi rằng viên bi bị mòn đều từ mọi phí, khối lượng riêng của sắt là 7,8 g/cm3)là:
A. 0,56cm B. 0,84cm C.0,78cm D.0,97cm
Đáp án: D
Số mol H+ là 0,1 mol
Khối lượng sắt bị tan là: 2,8 gam
Vậy thể tích sắt bị mất đi:
Thể tích ban đầu của viên bi:
Vậy thể tích của viên bi sắt còn lại sau phản ứng là: V2 = V1 – V = 3,83 cm3
Bán kính viên bi còn lại:
Bài 4: Nhóm A bao gồm các nguyên tố:
A. Nguyên tố s
B. Nguyên tố p
C. Nguyên tố d và nguyên tố f.
D. Nguyên tố s và nguyên tố p
Đáp án: D
Bài 5: Cho nguyên tố có kí hiệu là 12X. Vị trí của X trong bảng tuần hoàn:
A. Nhóm IIA, chu kì 3
B. Nhóm IA, chu kì 3
C. Nhóm IIIA, chu kì 2
D. Nhóm IA, chu kì 2
Đáp án: A

Bài 6: X, Y là 2 muối cacbonat của kim loại nhóm IIA thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Hoà tan 28,4 gam hỗn hợp X, Y bằng dung dịch HCl thu được 6,72 lít khí CO2 (đktc). Các kim loại nhóm IIA là:
A. Be và Mg. B. Mg và Ca.
C. Ca và Sr. D. Sr và Ba.
Đáp án: B
Gọi công thức chung của 2 kim loại là: R
RCO3 + H+ → R2+ + CO2 + H2O
nRCO3 = nCO2 = 0,3 mol = 28,4/(R + 60)
R = 34,6 ⇒ 2 Kim loại là: Mg(24); Ca(40)
Bài 7: Khi hoà tan hoàn toàn 3 gam hỗn hợp hai kim loại nhóm IA trong dung dịch HCl dư thu được 0,672 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được a gam muối khan, giá trị của a là
A. 4,90 gam B. 5,71 gam
C. 5,15 gam D. 5,13 gam
Đáp án: D
nH2 = 2nHCl = nCl- = 0,06 mol
mmuối = mKL + mCl- = 3 + 0,06. 35,5 = 5,13g
Bài 8: Độ âm điện của các nguyên tố: Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
A. Na < Mg < Al < Si
B. Si < Al < Mg < Na
C. Si < Mg < Al < Na
D. Al < Na < Si < Mg
Đáp án: A
Độ âm điện tăng → tính khử giảm
Bài 9: Bán kính nguyên tử các nguyên tố: Na, Li, Be, B. Xếp theo chiều tăng dần là:
A. B < Be < Li < Na
B. Na < Li < Be < B
C. Li < Be < B < Na
D. Be < Li < Na < B
Đáp án: A
Bài 10: R là một kim loại thuộc nhóm IA của bảng tuần hoàn. Lấy 17,55 gam R tác dụng với 25 gam dung dịch HCl 29,2%. Sau khi phản ứng xảy ra hoàn toàn cho bốc hơi cẩn thận dung dịch tạo thành trong điều kiện không có không khí thì thu được 28,9 gam hỗn hợp rắn gồm hai chất. Kim loại R là:
A. Na B. K C. Rb D. Cs
Đáp án: D
ta có nHCl = 0,2 mol
Xét các phản ứng:
Trong 28,9 gam chất rắn bao gồm ROH và RCl ⇒ 28,9 = mR+ + mCl- + mOH-
nCl- = nHCl = 0,2 mol; mR = 17,55 gam
nOH- = 0,25 mol
nR = 0,45 mol và MR = 39 ⇒ R là kim loại K
Bài 11: Phát biểu nào sau đây là sai ?
A. Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần.
B. Trong một nhóm theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng,
C. Kim loại có độ âm điện bé hơn phi kim trong cùng chu kì.
D. Đa số các kim loại đều có cấu tạo tinh thể.
Đáp án: A
Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại giảm dần
Bài 12: Nguyên tố X ở ô số 24 của bảng tuần hoàn. Một học sinh đã đưa ra các nhận xét về nguyên tố X như sau :
(1) X có 6 e hoá trị yà là nguyên tố kim loại.
(2) X là một nguyên tố nhóm d.
(3) X nằm ở chu kì 4 của bảng tuần hoàn.
(4) Ở trạng thái cơ bản, X có 6 e ở phân lớp s;
Trong các nhận xét trên, số nhận xét đúng là
A. 1. B. 2. C. 3. D. 4.
Đáp án: C
Cấu hình e của nguyên tố này là: 1s22s22p63s23p63d54s1
Các phát biểu 1,2,3 đúng
Bài 13: Xét 2 nguyên tố ở vị trí 19 và 29 trong bảng tuần hoàn. Kết luận nào sau đây là sai ?
A. Hai nguyên tố này cùng là kim loại.
B. Hai nguyên tố này thuộc cùng một chu’kì.
C. Hai nguyên tố này có cùng số e lớp ngoài cùng ở trạng thái cơ bản.
D. Hai nguyên tố này cùng là nguyên tố s.
Đáp án: D
Nguyên tố ở vị trí 19 có cấu hình e: 1s22s22p63s23p64s1 : là nguyên tố thuộc nhóm s
Nguyên tố ở vị trí 29 có cấu hình e: 1s22s22p63s23p63d104s1 : là nguyên tố thuộc nhóm d
Bài 14: Cấu hình electron nguyên tử của ba nguyên tố X, Y, Z lần lượt là ls22s22p63s2, ls22s22p63s23p64s1, ls22s22p63s1. Nếu xếp theo chiều tăng dần tính kim loại thì cách sắp xếp nào sau đây đúng ?
A. Y < Z < X. B. X < Z < Y.
C. X ≤ Y ≤ Z. D. Z < X < Y.
Đáp án: B
X và Z cùng chu kì, ZX > ZZ nên tính kim loại của X < Z
Y và Z cùng nhóm IA; ZY > ZZ nên tính kim loại của Y > Z
Suy ra tính kim loại: X < Z < Y
Bài 15: Kết luận nào sau đây sai?
A. Các nguyên tố nhóm A có cấu hình e lớp ngoài cùng ns2 đều là các kim loại.
B. Nguyên tố có Z = 19 có bán kính lớn hơn nguyên tố có Z = 11
C. Li là kim loại có độ âm điện lớn nhất trong số các kim loại kiềm
D. Các nguyên tố nhóm B đều là kim loại
Đáp án: A
he có cấu hình e lớp ngoài cùng là 1s2 và là khí hiếm