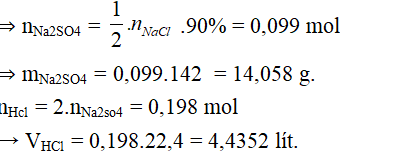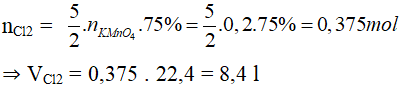Bài tập về nhóm Halogen chọn lọc, có đáp án
Bài tập về nhóm Halogen chọn lọc, có đáp án Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Bài tập về nhóm Halogen chọn lọc, có đáp án
Bài tập về nhóm Halogen chọn lọc, có đáp án
-
A. Bài tập tự luận
Bài 1. Nung 12,87 g NaCl với H2SO4 đặc, dư thu được bao nhiêu lít khí ở đktc và bao nhiêu gam muối Na2SO4, biết hiệu suất của phản ứng là H= 90%.
Hướng dẫn:
2NaCl + H2SO4 → Na2SO4 + 2HCl
Bài 2. Cho 31,6 g KMnO4 tác dụng với dung dịch HCl dư sẽ thu được bao nhiêu lít Cl2 (ở đktc) nếu H của phản ứng là 75%.
Hướng dẫn:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
nKMnO4 = 31,6/ 158 = 0,2 mol
Bài 3. Cho 0,896 lít Cl2 tác dụng với 200 ml dung dịch NaOH 1M ở to thường thu được dung dịch X. Tính CM của các chất trong dung dịch X ?
Hướng dẫn:
Cl2 + 2NaOH → NaCl + NaClO + H2O
nCl2 = 0,896/22,4 = 0,04 mol
nNaOH = 0,2 mol
Theo pt ⇒ nNaCl = nNaClO = nCl2 =0,04 mol
⇒ CMNaCl = CMNaClO = 0,04/0,2 = 0,2M
nNaOHdư = 0,2 – 0,04.2 = 0,12 mol ⇒ CMNaOH = 0,12 / 0,2 = 0,6M
-
Bài 4: Điện phân nóng chảy một muối 11,7g halogenua NaX người ta thu được 2,24 lít khí (đktc).
-
a) Xác định nguyên tố X ?
b) Tính thế tích khí HX thu được khi cho X tác dụng với 4,48 lít H2 ở đktc ?
c) Tính tỷ lệ % các khí sau phản ứng ?
Hướng dẫn:
PTHH: 2NaX → 2Na + X2
a, nX2 = 0,1 mol ⇒ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ⇒ X = 35,5 (Cl)
b, X2 + H2 → 2HX
nH2 = 0,2 mol ⇒ nHX = 2. nX2= 0,2 mol (H2 dư)
⇒ VHX = 0,2.22,4 = 4,48 l
c, Sau phản ứng có 0,2 mol khí HCl và 0,1 mol H2 dư
%HCl= 0,2/(0,2 + 0,1)= 66,67%
⇒ %H2 = 33,33%

-
B. Bài tập trắc nghiệm
-
Câu 1. Khi đun nóng muối kali clorat, không có xúc tác, thì muối này bị phân hủy đồng thời theo hai phương trình sau đây:
2KClO3 → 2KCl + 3O2 (1)
4KClO3 → 3KClO3 + KCl (2)
Biết rằng khi phân hủy hoàn toàn 73,5 gam kali clorat thì thu được 33,5 gam kali clorua. Vậy phần trăm khối lượng KClO3 phân hủy theo (1) là:
A. 80,23% B. 83,25% C. 85,1% D. 66,67%
Câu 2. Hidro clorua bị oxi hóa bởi MnO2 biết rằng khí clo tạo thành trong phản ứng đó có thể đẩy được 12,7 gam iot từ dung dịch natri iotua. Vậy khối lượng HCl là:
A. 7,3g B. 14,6g C. 3,65g D. 8,9g
Câu 3. Nguyên tố R là phi kim thuộc phân nhóm chính trong bảng tuần hoàn. Tỷ lệ % R trong oxit cao nhất với %R trong hợp chất khí với hidro là 0,5955. Vậy R là:
A. Flo B. Clo C. Brom D. Iot
Câu 4. Cho 19,05 gam hỗn hợp KF và KCl tác dụng hết với dung dịch H2SO4 đặc thu được 6,72 lít khí (đktc). Vậy % theo khối lượng của KF và KCl là:
A. 60,20% và 39,80% B. 60,89% và 39,11%
C. 39,11% và 60, 89% D. 70% và 30%
Câu 5. Dung dịch A chứa đồng thời axit HCl và H2SO4. Để trung hòa 40 ml A cần dùng vừa hết 60 ml NaOH 1M. Cô cạn dung dịch khi trung hòa, thu được 3,76 g hỗn hợp muối khan. Vậy nồng độ mol/l của hai axit HCl và H2SO4 là:
A. 1 và 0,75 B. 0,25 và 1 C. 0,25 và 0,75 D. 1 và 0,25
-
-
Câu 6. Cho 17,4 gam MnO2 tác dụng hết với HCl lấy dư. Toàn bộ khí clo sinh ra được hấp thụ hết vào 148,5 gam dung dịch NaOH 20% (ở nhiệt độ thường) tạo ra dung dịch A. Vậy dung dịch A có các chất và nồng độ % tương ứng như sau:
A. NaCl 10% ; NaClO 5%
B. NaCl 7,31%; NaClO 6,81%, NaOH 6%
C. NaCl 7,19%; NaClO 9,16%, NaOH 8,42%
D. NaCl 7,31%; NaClO 9,31%, HCl 5%