Cách nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S hay, chi tiết
Cách nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S hay, chi tiết
Cách nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S hay, chi tiết
-
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
-
Các bước làm một bài nhận biết:
- Trích mẫu thử.
- Dùng thuốc thử.
- Nêu hiện tượng.
- Viết phương trình phản ứng.
Lưu ý: Nếu hai mẫu thử có cùng tính chất, khi cho thuốc thử vào nhận biết thì hiện tượng sẽ trùng nhau, lúc đó ta tách chúng thành một nhóm, những mẫu thử khác không giống hiện tượng tách thành nhóm khác và tiếp tục sử dụng bảng nhận biết theo thứ tự sau
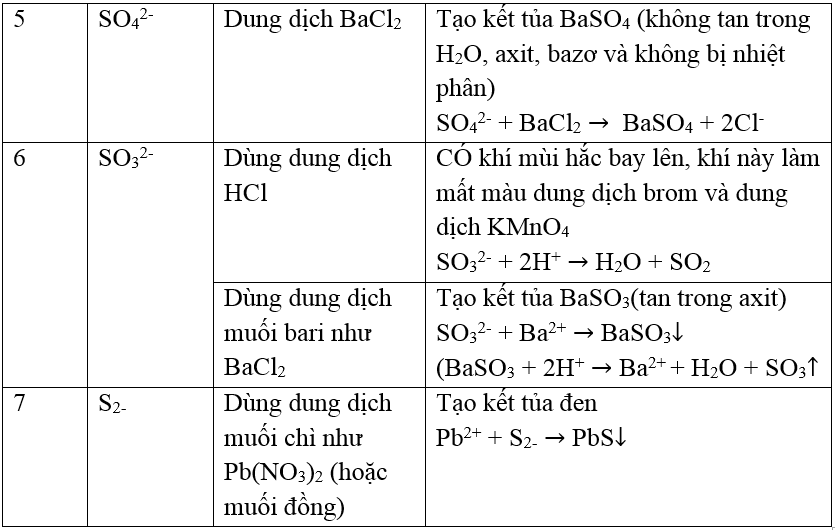
Bảng : Nhận biết O2, O3, S và các hợp chất
Ví dụ minh họa
Ví dụ 1: Có 4 lọ, mỗi lọ đựng một dung dịch không màu: NaCl, HCl, Na2SO4, Ba(NO3)2. Hãy nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra (nếu có).
Hướng dẫn:
Trích mỗi dung dịch một ít làm mẫu thử, cho quỳ tím lần lượt vào các mẫu thử, mẫu thử nào quỳ tím hóa đỏ là HCl.
Cho vài giọt dung dịch BaCl2 vào 3 mẫu thử cón lại, mẫu thử nào tạo kết tủa trắng là ống nghiệm đựng Na2SO4.
Na2SO4+ BaCl2 → NaCl + BaSO4↓
Cho vài giọt dung dịch Na2SO4 (đã biết) vào 2 mẫu thử còn lại, mẫu nào có kết tủa trắng là dung dịch Ba(NO3)2
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4↓
Còn lại dung dịch NACl, có thể khẳng định bằng dung dịch AgNO3
AgNO3 + NaCl → AgCl↓ + NaNO3
Ví dụ 2: Trình bày phương pháp hóa học nhận biết các dung dịch sau:Na2S, K2CO3, BaCl2, Na2SO3, NaCl.
Hướng dẫn:
Trích mỗi dung dịch một ít làm mẫu thử
Cho dung dịch H2SO4 lần lượt vào các mẫu thử trên
- Mẫu thử tạo kết tủa trắng là BaCl2
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
- Mẫu thử không có hiện tượng gì là NaCl
- Mẫu thử tạo khí có mùi trứng ung (trứng thối) là Na2S
Na2S + H2SO4 → Na2SO4 + H2S↑
- Mẫu thử tạo khí mùi hắc là Na2SO3.
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑+ H2O
- Mẫu thử tạo khí không màu, không mùi là K2CO3
K2CO3 + H2SO4 → K2SO4 + CO2↑+ H2O

Ví dụ 3: Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nòa khác làm thuốc thử. Viết phương trình hóa học nếu có.
Hướng dẫn:
Lấy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lầ lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
NaCl K2CO3 Na2SO4 HCl Ba(NO32 Kết luận NaCl K2CO3 ↑ ↓ ↑,↓ Na2SO4 ↓ ↓ HCl ↑ ↑ Ba(NO3)2 ↓ ↓ 2↓ -
Ví dụ 4: Có hai bình riêng biệt hai khí oxi và ozon. Trình bày phương pháp hóa học để phân biệt hai khí đó.
Hướng dẫn:
Dẫn lần lượt hai khí vào 2 dung dịch KI (chứa sẵn một ít tinh bột) nếu dung dịch có màu xanh xuất hiện thì khí dẫn là ozon.
2KI + O3 + H2O → I2 + O2 + KOH
I2 + hồ tinh bột → xanh
Khí còn lại không làm đổi màu là oxi.

-
B. Bài tập trắc nghiệm
Câu 1. Trình bày phương pháp hóa học nhận biết các dung dịch sau: Na2S, K2CO3, BaCl2, Na2SO3, NaCl.Câu 6. Cho các dung dịch không màu của các chất sau: NaCl, K2CO3. Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nòa khác làm thuốc thử. Viết phương trình hóa học nếu có.
Câu 2. Có bốn dung dịch A, B, C, D chứa các chất NaOH, HCl, H2SO4, H2O (không theo thứ tự trên). Lần lượt cho quỳ tím và dung dịch BaCl2 vào bốn dung dịch này và thấy:
A: làm quỳ tím hóa đỏ và tạo kết tủa trắng.
B: làm quỳ tím hỏa xanh và không tạo kết tủa.
C: không đổi màu quỳ tím và không tạo kết tủa.
D: làm quỳ tím hóa đỏ và không tạo kết tủa.
Tìm A, B, C, D. Giải thích, viết phản ứng.
Câu 3. Bằng phương pháp hóa học hãy nhận biết các khí: CO2, SO2, SO3.
Câu 4. Làm thế nào để tinh chế khí H2 trong hỗn hợp khí CO2 + H2.
- Câu 5. Có bốn lọ mất nhãn đựng bốn dung dịch K2SO3, K2SO4, (NH4)2SO3, (NH4)2SO4. Bằng phương pháp hóa học, hãy nhận biết các dung dịch này