Bộ 30 đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án
Bộ 30 đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 11 Giữa học kì 1. Mời các bạn cùng đón xem:
[Năm 2023] Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 1)
Câu 1. Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Axit càng nhiều H thì càng mạnh.
C. Bazơ mạnh là bazơ nhiều nấc.
D. Bazơ là chất khi tan trong nước phân li ra anion OH-.
Câu 2. Hòa tan m gam hỗn hợp X gồm hai muối vào nước thu được dung dịch chứa 0,05 mol Na+; 0,1 mol Mg2+; 0,2 mol Cl- và x mol SO42-. Giá trị của m là
A. 29,85.
B. 23,7.
C. 16,6.
D. 13,05.
Câu 3. Cho 4,48 lít CO2 vào 150 ml dung dịch Ca(OH)2 1M, cô cạn hỗn hợp các chất sau phản ứng ta thu được chất rắn có khối lượng là
A. 18,1 gam.
B. 15 gam.
C. 8,4 gam.
D. 20 gam.
Câu 4. Hỗn hợp X gồm (NH4)2SO4 và Na2CO3. Cho 2,91 gam X tác dụng với dung dịch BaCl2 dư thu được 5,285 gam kết tủa. Cho 2,91 gam X tác dụng với dung dịch KOH dư, thì số mol KOH đã phản ứng là
A. 0,030 mol.
B. 0,015 mol.
C. 0,020 mol.
D. 0,025 mol.
Câu 5: Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
A. 2
B. 6
C. 10
D. 12
Câu 6. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 7: Chọn phát biểu đúng trong số các phát biểu sau đây ?
A. Giá trị pH tăng thì độ axit tăng.
B. Dd có pH >7 làm quỳ tím hoá đỏ.
C. Dd có pH < 7 làm quỳ tím hoá xanh.
D. Giá trị pH tăng thì độ axit giảm.
Câu 8: Phản ứng nào không có phương trình ion thu gọn là: H+ + OH- → H2O
A. Ba(OH)2 + H2SO4
B. Ba(OH)2 + HNO3
C. KOH + HCl
D. Ba(OH)2 + HCl
Câu 9: Dãy gồm những chất điện li mạnh là:
A. HCl, NaCl, Na2CO3, Fe(OH)3.
B. NaF, NaOH, KCl, HClO
C. NaOH, KCl, H2SO4, KOH,
D. KNO3, MgCl2, HNO3 ,HF.
Câu 10: Chất nào sau đây không dẫn được điện:
A. KCl nóng chảy.
B. KCl rắn khan.
C. Dung dịch KCl.
D. Dung dịch
Câu 11: Chọn câu đúng
A. ở mọi nhiệt độ trong mọi dd ta luôn có: [H+].[OH-] = 10-14.
B. nước là chất điện li mạnh
C. dung dịch kali sunfit có pH >7
D. dd axit sunfuric làm phenolphthalein hóa đỏ
Câu 12: Chất nào sau đây lưỡng tính
A. KOH
B. Mg(OH)2
C. Zn(OH)2
D. HCl
Câu 13: cặp chất nào sau đây không xảy ra phản ứng trong dung dịch
A. CaCO3 + HCl
B. CH3COONa + HCl
C. CuSO4 + HNO3
D. AgNO3 + HCl
Câu 14: Trộn 250 ml dung dịch chứa HCl 0,08 M và H2SO4 0,01 M với 250 ml dung dịch NaOH aM được 500 ml dung dịch có pH = 12. Coi H2SO4 điện li hoàn toàn thì a bằng
A. 0,10 M
B. 0,15 M
C. 0,125 M
D. 0,12 M
Câu 15: Trường hợp nào sau đây các ion không cùng tồn tại trong một dung dịch?
A. Al3+ , SO42-, Mg2+, Cl-
B. Fe2+, NO3-, S2-, Na+
C. H+, NO3-, SO42-, Mg2+
D. K+, CO32-, SO42-
Câu 16: Phản ứng nào sau đây không phải phản ứng trao đổi ion?
A. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
B. 2NaOH + CuCl2 → 2NaCl + Cu(OH)2.
C. MgSO4 + BaCl2 → MgCl2 + BaSO4.
D. HCl + AgNO3 → AgCl + HNO3.
Câu 17: Bảo quản phot pho trắng bằng cách
A. ngâm trong nước.
B. ngâm trong dầu hỏa.
C. ngâm trong dung dịch vôi sữa.
D. để nơi khô ráo.
Câu 18: Nhận biết ion PO43- dùng thuốc thử AgNO3, vì phản ứng tạo ra
A. khí màu nâu.
B. tạo ra dung dịch có màu vàng.
C. kết tủa có màu vàng.
D. khí không màu hoá nâu trong không khí.
Câu 19: Phát biểu nào sau đây không đúng?
A. Amoniac là khí không màu, không mùi, tan nhiều trong nước.
B. Amoniac là một bazơ.
C. Đốt cháy NH3 không có xúc tác thu được N2 và H2O.
D. Phản ứng tổng hợp NH3 từ N2 và H2 là phản ứng thuận nghịch.
Câu 20: Tổng hệ số (số nguyên, tối giản) của các chất trong phương trình phản ứng giữa Al với HNO3 loãng tạo sản phẩm khử duy nhất N2O là
A. 48.
B. 11.
C. 64.
D. 9.
Câu 21: Có 4 dung dịch mất nhãn đựng trong 4 lọ riêng biệt: AlCl3, NH4NO3, (NH4)2CO3 và Fe(NO3)2. Thuốc thử để phân biệt 4 lọ trên là dung dịch
A. NaOH.
B. H2SO4.
C. Ba(OH)2.
D. AgNO3.
Câu 22: Cho a mol KOH vào dung dịch chứa b mol H3PO4 (tỉ lệ a/b = 2/1). Sau phản ứng dung dịch chứa muối
A. KH2PO4 và K2HPO4.
B. K2HPO4.
C. KH2PO4.
D. KH2PO4, K2HPO4 và K3PO4.
Câu 23: Cho dung dịch NaOH vào 100 ml dung dịch (NH4)2SO4 1M, đun nóng thu được V lít khí (đktc). Giá trị của V là
A. 8,96.
B. 3,36.
C. 4,48.
D. 6,72.
Câu 24: Cho 1,35 gam hỗn hợp gồm Mg, Al, Cu vào dung dịch HNO3 dư thu được hỗn hợp khí gồm 0,01 mol NO và 0,04 mol NO2 (không có sản phẩm khử khác). Cô cạn dung dịch sau phản ứng thu được hỗn hợp muối có khối lượng là (Cho: Mg=24, O=16, N=14, H=1, Cu=64, Al=27)
A. 5,69 gam.
B. 5,5 gam.
C. 4,98 gam.
D. 4,72 gam.
Câu 25: Tiến hành các thí nghiệm sau:
(1) Sục khí H2S vào dung dịch FeSO4.
(2) Sục khí H2S vào dung dịch CuSO4.
(3) Sục khí SO2 vào dung dịch NaOH dư.
(4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2.
(5) Sục H2S và dung dịch Ca(OH)2 dư.
(6) Nhỏ từ từ dung dịch K2CO3 vào dung dịch FeCl3.
(7) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(8) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Số thí nghiệm tạo ra kết tủa là
A. 4.
B. 5.
C. 6.
D. 7.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 2)
Câu 1: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ có thể xảy ra khi :
A. tạo thành chất kết tủa.
B. tạo thành chất điện li yếu.
C. tạo thành chất khí.
D. có ít nhất một trong 3 điều kiện trên.
Câu 2: Nhận định nào sau đây đúng?
A. Nitơ không duy trì sự hô hấp vì nitơ là một khí độc.
B. Vì có liên kết ba, nên phân tử nitơ rất bền và ở nhiệt độ thường khá trơ về mặt hóa học.
C. Khi tác dụng với kim loại hoạt động, nitơ thể hiện tính khử.
D. Trong phản ứng: N2 + O2 → 2NO, nitơ thể hiện tính oxi hóa.
Câu 3: Các ion nào sau đây không cùng tồn tại trong một dung dịch:
A. NH4+, OH–, Fe3+, Cl– .
B. Fe3+, NO3–, Mg2+, Cl–
C. Na+, NO3–, Mg2+, Cl– .
D. H+, NH4+, SO42–, Cl–
Câu 4: Trong phản ứng: HNO3 + P → H3PO4 + NO2 + H2O. Hệ số của P (số nguyên, tối giản) là
A. 1.
B. 2.
C. 4.
D. 5.
Câu 5: Dung dịch KOH 0,0001M có pH bằng:
A. 11
B. 3
C. 4
D. 10
Câu 6: Nhận xét nào sau đây sai ?
A. Dung dịch axit có chứa ion H+ .
B. Dung dịch HNO3 có [ H+] > 10-7M
C. Dung dịch bazơ có chứa ion OH –
D. Dung dịch muối không bao giờ có tính axit hoặc bazơ.
Câu 7: Phương trình điện li nào sau đây viết sai ?
A. Na2SO4 Na2+ + SO42 –
B. Fe(NO3)3 Fe3+ + 3NO3–
C. Al2(SO4)3 2Al3+ + 3SO42–
D. K2CrO4 K+ + CrO42 –
Câu 8: Phương trình phân tử: CaCO3 + 2HCl ® CaCl2 + CO2 + H2O có phương trình ion rút gọn sau?
A. CaCO3 + 2H + → Ca2+ + CO2 + H2O.
B. Ca2+ + 2Cl – → CaCl2 .
C. 2H+ + CO32– → CO2 + H2O.
D. CaCO3 + 2H+ + 2Cl – → CaCl2 + CO2 + H2O.
Câu 9: Cho các muối sau: NaHSO4 , NaHCO3 , Na2HPO3 . Muối axit trong số đó là:
A. cả 3 muối
B. NaHSO4, NaHCO3
C. Na2HPO3
D. NaHSO4
Câu 10: Nhận định nào sau đây đúng về axit photphoric?
A. Tính oxi hóa mạnh vì photpho có số oxi hoá cao nhất +5.
B. Tính khử mạnh vì hiđro có số oxi hóa +1.
C. Độ mạnh trung bình, trong dung dịch phân li theo 3 nấc.
D. Axit thường dùng là dung dịch đặc, sánh, màu vàng.
Câu 11: Nhận định nào sau đây không đúng?
A. Amoniac là khí không màu, không mùi, tan nhiều trong nước.
B. Amoniac là một bazơ.
C. Đốt cháy NH3 không có xúc tác thu được N2 và H2O.
D. Phản ứng tổng hợp NH3 từ N2 và H2 là phản ứng thuận nghịch.
Câu 12: Khi cho kim loại Cu phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào sau đây xử lý tốt nhất để chống ô nhiễm môi trường?
A. Nút ống nghiệm bằng bông tẩm nước.
B. Nút ống nghiệm bằng bông tẩm cồn.
C. Nút ống nghiệm bằng bông tẩm giấm.
D. Nút ống nghiệm bằng bông tẩm nước vôi.
Câu 13: Công thức hóa học của magie photphua là
A. Mg2P3.
B. MgP.
C. Mg3P2.
D. Mg3(PO4)2.
Câu 14: Phân lân được đánh giá bằng hàm lượng phần trăm của
A. P.
B. P2O5.
C. H3PO4.
D. Ca3(PO4)2.
Câu 15: Dãy nào sau đây gồm tất cả các muối đều ít tan hoặc không tan trong nước?
A. AgNO3, Na3PO4, CaHPO4.
B. AgI, BaHPO4, Ca3(PO4)2.
C. AgCl, Ba(H2PO4)2, Ca(NO3)2.
D. AgF, CuSO4, Ca(H2PO4)2.
Câu 16: Nitơ phản ứng được với tất cả các chất trong nhóm nào sau đây đều tạo ra hợp chất khí?
A. Li, Mg, Al.
B. Li, H2, Al.
C. H2, O2 .
D. O2, Ca, Mg.
Câu 17: Có thể nhận biết muối amoni bằng kiềm mạnh vì
A. muối amoni chuyển thành màu đỏ.
B. thoát ra một chất khí không màu, mùi khai và xốc.
C. thoát ra một chất khí không màu hóa nâu trong không khí.
D. thoát ra chất khí không màu, không mùi.
Câu 18: Nếu trộn 100 ml dung dịch HCl 0,01M với 100 ml dung dịch H2SO4 0,005M thì dung dịch thu được có pH là (Biết H2O bay hơi không đang kể):
A. 2
B. 3,12
C. 4
D. 1
Câu 19: Cho các chất sau: HCl, H2S, HNO3, NaOH, Ca(OH)2, Al(OH)3, NaCl, BaCl2. Có bao nhiêu chất điện li yếu?
A. 3
B. 5
C. 4
D. 2
Câu 20: Phản ứng nào dưới đây là phản ứng trao đổi ion trong dd ?
A. Zn + H2SO4 → ZnSO4 + H2
B. Zn + 2Fe(NO3)3 → Zn(NO3)2 + 2Fe(NO3)2
C. Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3
D. 2Fe(NO3)3 + 2KI → 2Fe(NO3)2 + I2 + 2KNO3
Câu 21: Phản ứng nào sau đây không phải là phản ứng axit–bazơ ?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl
B. H2SO4 + 2NaOH → Na2SO4 + 2H2O
C. 6HCl + Fe2O3 → 2FeCl3 + 3H2O
D. Ca(OH)2 + CO2 → CaCO3 + H2O
Câu 22: Đun nóng (có xúc tác) 4 lit hỗn hợp X gồm N2 và H2, dX/H2 = 4,25, hiệu suất phản ứng 25%. Thể tích NH3 thu được ở cùng điều kiện là
A. 2 lít.
B. 0,25 lít.
C. 0,5 lít.
D. 1 lít.
Câu 23: Cho các phản ứng sau trong điều kiện thích hợp: (1) S + HNO3, (2) FeO + HNO3, (3) Fe2O3 + HNO3, (4) HCl + NaOH, (5) Mg + HCl, (6) Cu + HNO3. Số phản ứng oxi hóa - khử là
A. 5.
B. 4.
C. 3.
D. 2.
Câu 24: Dung dịch CH3COOH 0,1M phải có
A. pH < 1
B. pH > 7
C. pH = 7
D. 1 < pH < 7
Câu 25: Chia m gam hỗn hợp X gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
Phần 1: tác dụng hoàn toàn với HNO3 đặc nguội thu được 0,672 lít khí (đktc).
Phần 2: tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 0,448 lít khí (đktc).
Giá trị của m là (Cho: Cu=64, Fe=56, N=14, H=1, O=16)
A. 4,96.
B. 8,80.
C. 4,16.
D. 17,6
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 3)
Câu 1: Dung dịch X gồm 0,15 mol K+; 0,3 mol Mg2+; 0,25 mol Na+; a mol Cl- và b mol SO42-. Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
A. 0,4.
B. 0,3.
C. 0,2.
D. 0,5.
Câu 2: Phương trình điện li nào sau đây không đúng?
A. H2SO4 → 2H+ + SO42- .
B. CH3COOH ⇌ CH3COO- + H+ .
C. HF → H+ + F-.
D. KClO → K+ + ClO- .
Câu 3: Dung dịch nào sau đây không dẫn điện?
A. Dung dịch HCl trong nước.
B. Dung dịch glucozơ trong nước.
C. Dung dịch NaCl trong nước.
D. Dung dịch NaOH trong nước.
Câu 4: Một dung dịch có [H+] < [OH-] thì dung dịch đó có môi trường
A. axit.
B. bazơ.
C. trung tính.
D. không xác định được.
Câu 5: Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, PO43-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3-.
D. K+, Al3+, Cl-, CO32-.
Câu 6: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. CaO + CO2 → CaCO3.
B. Fe + CuCl2 → FeCl2 + Cu.
C. Ba(NO3)2 + 2NaOH → Ba(OH)2 + 2NaNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Câu 7: Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Axit axetic (CH3COOH) là axit nhiều nấc.
B. Một hợp chất trong thành phần phân tử có hiđro là axit.
C. Bazơ là chất khi tan trong nước phân li ra ion OH-.
D. Một hợp chất trong thành phần phân tử có nhóm OH là bazơ.
Câu 8: Chất X là muối khi tan trong nước tạo ra dung dịch có môi trường axit. Khi cho X tác dụng với dung dịch BaCl2 dư hay dung dịch KOH dư đều thu được kết tủa (sau khi phản ứng xảy ra hoàn toàn). X là
A. Al2(SO4)3.
B. ZnSO4.
C. Na2SO4.
D. CuSO4.
Câu 9: Trong dung dịch H3PO4 có tất cả bao nhiêu anion (bỏ qua sự phân li của nước)?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10: Dung dịch gồm NaOH 0,2M và Ba(OH)2 0,1M có giá trị pH là
A. 13,6.
B. 0,4.
C. 0,5.
D. 13,5.
Câu 11: Cho các chất sau: K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Ag; Cr(OH)3; Cu(OH)2; Al; Zn; CuS. Số chất tác dụng được với HCl là
A. 8.
B. 10.
C. 9.
D. 7.
Câu 12: Muối nào sau đây là muối axit?
A. NH4HCO3.
B. HCOONa.
C. HCOONH4.
D. (NH4)2CO3.
Câu 13: Cho các dung dịch có cùng nồng độ 0,01M: Ba(OH)2 (1); H2SO4 (2); NaOH (3); Na2SO4 (4). Thứ tự giảm dần giá trị pH của các dung dịch đó là
A. (2), (4), (3), (1).
B. (1), (3), (4), (2).
C. (1), (3), (2), (4).
D. (2), (3), (4), (1).
Câu 14: Trong số các chất sau: HNO2, CH3COOH, C6H6, HCOOH, C6H12O6, C2H5OH, NaClO, CH4, NaOH, NH4NO3 , H2S. Số chất thuộc loại chất điện li yếu là
A. 7.
B. 5.
C. 6.
D. 4.
Câu 15: Cho các phản ứng hóa học sau:
(1) (NH4)2SO4 + BaCl2→ (2) CuSO4 + Ba(NO3)2→
(3) Na2SO4 + BaCl2→ (4) H2SO4 + BaSO3→
(5) (NH4)2SO4 + Ba(OH)2→ (6) Fe2(SO4)3 + Ba(NO3)2→
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Câu 16: Tiến hành các thí nghiệm sau:
(1) Sục khí SO2 vào dung dịch H2S.
(2) Sục khí NH3 tới dư vào dung dịch AlCl3.
(3) Cho mẩu Na vào dung dịch CuSO4.
(4) Sục khí CO2 tới dư vào dd Ca(OH)2
(5) Cho dung dịch AgNO3 vào dung dịch NaCl.
(6) Sục khí H2S tới dư vào dd Pb(NO3)2
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
A. 3.
B. 5.
C. 4.
D. 2.
Câu 17: Xác định chất (A) và (B) trong chuỗi sau :
N2 NH3 (A) (B) HNO3
A. (A) là NO, (B) là N2O5
B. (A) là NO, (B) là NO2
C. (A) là N2, (B) là N2O5
D. (A) là N2, (B) là NO2
Câu 18: Phương trình phản ứng nào dưới đây có phương trình ion rút gọn là:
H+ + OH- → H2O :
A. NH4Cl + NaOH→ NH3 + H2O + NaCl
B. Mg(OH)2 + 2HNO3→ Mg(NO3)2+ 2H2O
C. NaOH + HNO3 → NaNO3 + H2O
D. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Câu 19: Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được 560 ml lít khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là
A. 40,5 gam.
B. 14,62 gam.
C. 24,16 gam.
D. 14,26 gam.
Câu 20: Hòa tan các chất sau: KOH, C2H5OH, C12H22O11, NaCl vào nước để thu được các dung dịch riêng rẽ. Trong các dung dịch thu được, có bao nhiêu dung dịch có khả năng dẫn điện?
A. 3
B. 2
C. 5
D. 6
Câu 21: Dãy các chất đều tác dụng với dung dịch Ba(OH)2 là:
A. NaHCO3, Na2CO3, CO2, MgSO4 , HCl
B. Mg(NO3)2, HCl, BaCl2, NaHCO3, Na2CO3
C. NaHCO3, Na2CO3, CO2, Mg(NO3)2, Ba(NO3)2
D. Ba(NO3)2, Mg(NO3)2, HCl, CO2, Na2CO3.
Câu 22: Cho V lít (đktc) hỗn hợp N2 và H2 có tỷ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng được 1,5 mol NH3. Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít
B. 268,8 lít
C. 336 lít
D. 448 lít
Câu 23: Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 0,5M và HNO3 0,5M vào 100 ml dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M, thu được V lít khí CO2 (ở đktc). Giá trị của V là
A. 1,12.
B. 2,24.
C. 3,36.
D. 4,48.
Câu 24: Có 4 dung dịch không màu: NH4Cl, (NH4)2SO4, BaCl2, Na2CO3 đựng trong 4 lọ mất nhãn riêng biệt. Dùng một dung dịch thuốc thử dưới đây để phân biệt 4 lọ trên
A. NaCl.
B. NH3.
C. NaNO3.
D. Ba(OH)2.
Câu 25: Nung 2,23 gam hỗn hợp X gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 2,71 gam hỗn hợp Y. Hoà tan hoàn toàn Y vào dung dịch HNO3(dư), thu được 0,672 lít khí NO (sản phẩm khử duy nhất, ở đktc). Số mol HNO3 đã phản ứng
A. 0,12.
B. 0,14.
C. 0,16.
D. 0,18.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 4)
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Dung dịch nào sau đây làm quỳ tím hóa đỏ?
A. Dung dịch có pH = 8.
B. Dung dịch có pH = 10.
C. Dung dịch có pH = 4.
D. Dung dịch có pH = 7.
Câu 2. Trong số các muối sau: KHSO4, CH3COONa, NH4Cl, Ca3(PO4)2, số muối axit là
A. 3.
B. 1.
C. 2.
D. 4.
Câu 3. Phản ứng xảy ra trong dung dịch giữa cặp chất nào sau đây là phản ứng trao đổi ion?
A. BaCl2 + K2SO4.
B. SO2 + H2S.
C. Cu + H2SO4 đặc.
D. Fe + HCl.
Câu 4. Có 4 dung dịch: NaOH, NaCl, CH3COOH, Na2SO4 đều có nồng độ 0,1M. Dung dịch có tổng nồng độ mol của các ion nhỏ nhất là
A. NaCl.
B. NaOH.
C. CH3COOH.
D. Na2SO4.
Câu 5. Hiđroxit nào sau đây là hiđroxit lưỡng tính?
A. Fe(OH)3.
B. Zn(OH)2.
C. KOH.
D. Ba(OH)2.
Câu 6. Dãy chất nào sau đây, trong nước đều là chất điện li yếu ?
A. H2S, HCl, NH3.
B. CuCl2, HCOOH, Ba(OH)2.
C. H2S, CH3COOH, H3PO4.
D. NaCl, H2SO3, Al2(SO4)3.
Câu 7. Theo thuyết Areniut, phát biểu nào sau đây đúng?
A. Một hợp chất trong thành phần phân tử có hiđro là axit.
B. Axit càng nhiều H thì càng mạnh.
C. Bazơ mạnh là bazơ nhiều nấc.
D. Bazơ là chất khi tan trong nước phân li ra anion OH-.
Câu 8. Trong số các chất sau: Cu(OH)2, Ba(NO3)2, HClO2, H2S, chất điện li mạnh là
A. HClO2.
B. H2S.
C. Ba(NO3)2.
D. Cu(OH)2.
Câu 9. Hòa tan m gam hỗn hợp X gồm hai muối vào nước thu được dung dịch chứa 0,05 mol Na+; 0,1 mol Mg2+; 0,2 mol Cl- và x mol SO42-. Giá trị của m là
A. 29,85.
B. 23,7.
C. 16,6.
D. 13,05.
Câu 10. Cho 4 dung dịch loãng, có cùng nồng độ mol: C2H5COOH, HCl, NH3, Ba(OH)2. Dung dịch có pH nhỏ nhất và lớn nhất lần lượt là
A. HCl và NH3.
B. CH3COOH và Ba(OH)2.
C. HCl và Ba(OH)2.
D. CH3COOH và NH3.
Câu 11. Cho 4,48 lít CO2 vào 150 ml dung dịch Ca(OH)2 1M, cô cạn hỗn hợp các chất sau phản ứng ta thu được chất rắn có khối lượng là
A. 18,1 gam.
B. 15 gam.
C. 8,4 gam.
D. 20 gam.
Câu 12. Thí nghiệm nào sau đây có sinh ra chất khí nhưng không sinh ra chất kết tủa?
A. Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2.
B. Cho dung dịch FeCl3 vào dung dịch NH3.
C. Cho dung dịch (NH4)2CO3 vào dung dịch Ca(OH)2.
D. Cho dung dịch HCl vào dung dịch NH4HCO3.
Câu 13. Cho từ từ 65 ml dung dịch HCl 1,6M vào 70 ml dung dịch Na2CO3 0,8M, sau khi các phản ứng kết thúc thu được V lít khí (đktc). Giá trị của V là
A. 0,2668.
B. 0,9408.
C. 1,0752.
D. 0,8064.
Câu 14. Hỗn hợp X gồm (NH4)2SO4 và Na2CO3. Cho 2,91 gam X tác dụng với dung dịch BaCl2 dư thu được 5,285 gam kết tủa. Cho 2,91 gam X tác dụng với dung dịch KOH dư, thì số mol KOH đã phản ứng là
A. 0,030 mol.
B. 0,015 mol.
C. 0,020 mol.
D. 0,025 mol
Câu 15. Trộn ba dung dịch: HCl 0,2M; H2SO4 0,1M và HNO3 0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH = x. Giá trị của x là
A. 4.
B. 1.
C. 2.
D. 3.
Phần II: Tự luận (3 điểm)
Câu 1: (1 điểm) Viết phương trình phản ứng dạng phân tử và ion rút gọn xảy ra trong dung dịch:
a. CuCl2 + NaOH
b. (NH4)2SO4 + Ba(OH)2
Câu 2:( 2 điểm) Khi hòa tan hoàn toàn 18,3 gam hỗn hợp Al và Al2O3 trong dung dịch HNO3 10%, thấy thoát ra 6,72 lít khí không màu hóa nâu trong không khí (ở đktc, sản phẩm khử duy nhất) .
a. (1 điểm) Tính thành phần phần trăm về khối lượng trong hỗn hợp trên.
b. (1 điểm) Tính khối lượng dung dịch axit HNO3 cần dùng
Cho NTK của H=1, N=14,O=16, Al=27
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 4
I. Trắc nghiệm
Câu 1. C
Dung dịch có pH = 4 < 7: môi trường axit, làm quỳ tím chuyển sang màu đỏ.
Câu 2. B
Muối axit là muối mà gốc axit vẫn còn hiđro phân li ra H+.
Vậy muối axit là KHSO4.
Câu 3. A
BaCl2 + K2SO4 → BaSO4 ↓ + 2KCl
B, C, D sai vì là phản ứng oxi hóa – khử.
Câu 4. C
Trong các chất trên chỉ có CH3COOH là chất điện li yếu nên có tổng nồng độ mol của các ion là nhỏ nhất.
Câu 5. B
Zn(OH)2 là hiđroxit lưỡng tính.
Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ ZnO22- + 2H+.
Câu 6. C
H2S, CH3COOH, H3PO4 là các axit yếu nên là các chất điện li yếu.
Câu 7. D
Câu 8. C
Ba(NO3)2 là muối tan nên là chất điện li mạnh.
Câu 9. D
Bảo toàn điện tích có: 0,05 + 0,1.2 = 0,2 + 2x → x = 0,025.
mmuối = ∑mion = 0,05.23 + 0,1.24 + 0,2.35,5 + 0,025.96 = 13,05 (gam).
Câu 10. C
Axit càng mạnh thì pH càng nhỏ → HCl có pH nhỏ nhất.
Bazơ càng mạnh thì pH càng lớn → Ba(OH)2 có pH lớn nhất.
Câu 11. B
Ta có: ![]()
Sau phản ứng thu được các muối CaCO3: x mol và Ca(HCO3)2 y mol.
Bảo toàn C có: x + 2y = 0,2 (1)
Bảo toàn Ca có: x + y = 0,15 (2)
Từ (1) và (2) có x = 0,1 và y = 0,05.
Cô cạn hỗn hợp phản ứng:
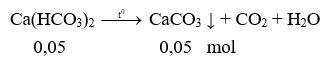
Chất rắn sau phản ứng là CaCO3 (0,1 + 0,05 = 0,15 mol)
mcr = 0,15.100 = 15 gam.
Câu 12. D
HCl + NH4HCO3 → NH4Cl + CO2↑ + H2O.
Câu 13. C
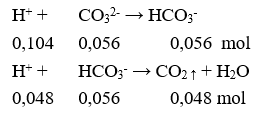
Vkhí = 0,048.22,4 = 1,0752 lít.
Câu 14. C
Gọi số mol (NH4)2SO4 và Na2CO3 lần lượt là x và y mol
mX = 2,91 (gam) → 132x + 106y = 2,91(1)
Cho X tác dụng với BaCl2 dư:
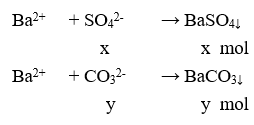
m↓ = 5,285 gam → 233x + 197y = 5,285 (2)
Từ (1) và (2) có x = 0,01 và y = 0,015.
Cho X tác dụng với KOH dư:
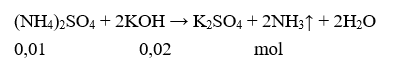
Vậy số mol KOH đã phản ứng là 0,02 mol.
Câu 15. D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ nH+ = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
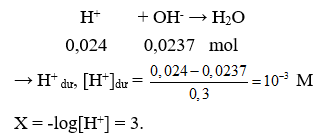
II. Tự luận
Câu 1:
a) CuCl2 + 2NaOH Cu(OH)2 + 2NaCl
Cu2+ + 2OH- Cu(OH)2
b) (NH4)2SO4 + Ba(OH)2 2NH3 + BaSO4 + 2H2O
2NH4+ + SO42- + Ba2+ + 2OH- NH3 + BaSO4 + 2H2O
Câu 2:
a)
Al +4HNO3Al(NO3)3+ NO + 2H2O (1)
Al2O3 + 6HNO3 2Al(NO3)3 + 3H2O (2)
Theo (1), mAl= 0,3x27=8,1 (g)
mAl2O3= 18,3-8,1=10,2 (g)
b) Theo (1 (2) nHNO3= 4x0,3 + 6x
mHNO3 =1,8x63=113,4g
mdd HNO3=
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 5)
Phần I: Trắc nghiệm
Câu 1. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 2. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 3. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 4. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 5. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 6. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 7. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 8. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 9. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 10. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
B. [H+] > [NO3-].
C. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 11. Cho 5g NaCl vào dung dịch chứa 8,5g AgNO3 thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu 12. Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd Ba(OH)2 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu 13. Một dung dịch có pH = 3. Nống độ ion H+ là
A. 0,003.
B. 0,01.
C. 0,1.
D. 0,001.
Câu 14: Tiến hành các thí nghiệm sau:
(1) Sục khí H2S vào dung dịch FeSO4.
(2) Sục khí H2S vào dung dịch CuSO4.
(3) Sục khí SO2 vào dung dịch NaOH dư.
(4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2.
(5) Sục H2S và dung dịch Ca(OH)2 dư.
(6) Nhỏ từ từ dung dịch K2CO3 vào dung dịch FeCl3.
(7) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(8) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Số thí nghiệm tạo ra kết tủa là
A. 4.
B. 5.
C. 6.
D. 7.
Câu 15: Cho 0,266 lít dung dịch X gồm NaOH 0,5M và Ba(OH)2 0,25M vào 140 ml dung dịch Al2(SO4)3 0,3 M thu được m gam kết tủa. Giá trị của m là
A. 5,46.
B. 20,9545.
C. 34,818.
D. 15,4945.
Phần II: Tự luận
Câu 1.Viết phương trình hóa học
a. Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng xảy ra sau:
CaCO3 +HCl
b. Viết phương trình nhiệt phân các muối trong các trường hợp sau:
NH4NO3; Ca(NO3)2, MgCO3
c. Lập PTHH các phản ứng sau: C + HNO3 đặc
Câu 2: Hòa tan 21,60 gam hỗn hợp X ( gồm Fe và CuO ) bằng dung dịch HNO3 dư thu được dung dịch Y và 2,24 lít NO ( đktc) là sản phẩm khử duy nhất .
a) Viết phương trình hóa học xảy ra.
b) Xác định thành phần % của các chất trong hỗn hợp đầu hỗn hợp ban đầu.
Câu 3: Khi hòa tan hết 1,80 gam hỗn hợp A gồm Mg và Al trong dung dịch HNO3 loãng vùa đủ thu được hỗn hợp khí Y gồm 0,01mol N2 và 0,01mol N2O ( không có thêm sản phẩm khử khác) và dung dịch X. Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp đầu.
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 5
I. Phần trắc nghiệm (6đ)
Câu 1. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3- ⇌ H+ + CO32-.
Câu 2. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 3. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 4. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 5. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 6. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 7. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 8. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 9. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 10. A
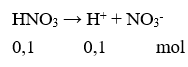
Câu 11. A
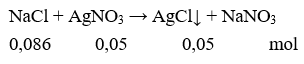
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Câu 12. B
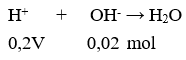
Có 0,2V = 0,02 → V = 0,1 lít = 100 ml.
Câu 13. D
[H+] = 10-pH = 10-3 = 0,001 (M).
Câu 14. A
(1) H2S + FeSO4 → không phản ứng.
(2) H2S + CuSO4 → CuS↓ + H2SO4.
(3) SO2 + 2NaOH dư → Na2SO3 + H2O
(4) 2CO2 dư + Ca(OH)2 → Ca(HCO3)2.
(5) H2S + Ca(OH)2 dư → CaS + 2H2O
(6) 3K2CO3 + 2FeCl3 + 3H2O→ 2Fe(OH)3↓ + 6KCl + 3CO2↑
(7) 6NH3 dư + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
(8) Ba2+ + SO42- → BaSO4↓
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 ↓ + OH- → AlO2- + 2H2O
Vậy các thí nghiệm (2); (6); (7); (8) tạo ra kết tủa.
Câu 15. B

Kết tủa sau phản ứng gồm:
BaSO4: 0,0665 mol và Al(OH)3: 0,084 – 0,014 = 0,07 mol.
m = 0,0665.233 + 0,07.78 = 20,9545 gam.
II. Phần tự luận
Câu 1:
a CaCO3+ 2HCl → CaCl2 + H2O + CO2 ↑
CaCO3+ 2H+ → Ca2+ + H2O + CO2 ↑
b. NH4NO3N2O + 2H2O
Ca(NO3)2 Ca(NO2)2 + O2
MgCO3 MgO + CO2
c. C + 4HNO3đặc CO2 +4NO2 +2H2O
Câu 2:
nNO ==0,1 (mol)
a. PTHH:
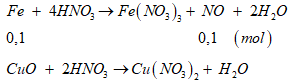
b.
%mFe= 25,93%;
% mCuO= 100- 44, 83=74,07%
Câu 3:
Gọi nMg=x(mol); nAl= y(mol) (x,y>0)
Áp dụng định luật bảo toàn số mol e có hệ pt
2x+ 3y= 0,18
24x + 27y=1,8
Tìm ra x=0,03(mol) ; y=0,04 (mol).
%mMg= 40%; %mAl= 60 %.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 6)
Phần I: Trắc nghiệm
Câu 1. Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd Ba(OH)2 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu 2. Chất nào sau đây là axit theo a – rê – ni – uyt?
A. HClO.
B. CsOH.
C. NH4Cl.
D. CH3COONa.
Câu 3. Trộn hai thể tích bằng nhau của dung dịch HNO3 và dung dịch NaOH có cùng nồng độ mol/l. Giá trị pH của dung dịch sau phản ứng là
A. pH = 2.
B. pH = 7.
C. pH > 7.
D. pH < 7.
Câu 4. Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] < 0,10M.
B. [H+] = 0,10M.
C. [H+] < [CH3COO-].
D. [H+] > [CH3COO-].
Câu 5. Cho 5g NaCl vào dung dịch chứa 8,5g AgNO3 thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu 6. Chất nào sau đây không dẫn được điện?
A. NaCl nóng chảy.
B. CaCl2 nóng chảy.
C. HBr hoà tan trong H2O.
D. NaCl rắn, khan.
Câu 7. Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính?
A. Al(OH)3.
B. Cr(OH)3.
C. Ba(OH)2.
D. Pb(OH)2.
Câu 8. Phản ứng nào sau đây không xảy ra?
A. NaOH + HCl.
B. KOH + NaCl
C. NaOH + Cl2.
D. NaOH + Zn(OH)2.
Câu 9. pH của dung dịch KOH 0,01M là
A. 8.
B. 12.
C. 11.
D. 9.
Câu 10. Ở 25°C, tích số K = [H+].[OH-] = 1,0.10-14 được gọi là
A. tích số tan của nước.
B. tích số phân li của nước.
C. độ điện li của nước .
D. tích số ion của nước.
Câu 11. Cụm từ nào sau đây còn thiếu trong dấu “…” ở câu sau: “Các dung dịch axit, bazơ, muối dẫn điện được là do trong dung dịch của chúng có các … chuyển động tự do”.
A. electron.
B. phân tử.
C. ion.
D. nguyên tử.
Câu 12. Phương trình ion rút gọn của phản ứng cho biết:
A. Không tồn tại phân tử trong dung dịch các chất điện li.
B. Nồng độ các trong dung dịch.
C. Các ion tồn tại trong dung dịch.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. Một dung dịch có pH = 3. Nống độ ion H+ là
A. 0,003.
B. 0,01.
C. 0,1.
D. 0,001.
Câu 14. Chất nào sau đây là chất điện li mạnh
A. KClO4.
B. HCl.
C. KOH.
D. Cả A,B,C.
Câu 15. Theo A-rê-ni-ut, axit là
A. chất khi tan trong nước phân li ra anion H+.
B. chất khi tan trong nước phân li ra cation H+.
C. chất khi tan trong nước phân li ra anion OH-.
D. Tất cả đều sai.
Câu 16. Muối axit là
A. Muối tạo bởi bazơ yếu và axit mạnh.
B. Muối vẫn còn hiđro có khả năng phân li ra cation H+.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối có khả năng phản ứng với bazơ.
Phần II: Tự luận
Câu 1(1.5 điểm) Viết phương trình điện li của:
a) Na2SO4.
b) HCl.
c) HCOOH.
Câu 2 (1.5 điểm). Hoàn thành các phương trình hóa học sau:
a. Viết phương trình hóa học dạng ion rút gọn của phản ứng sau
Na2CO3 + HCl → ? + ? + ?
b. Viết một phương trình hóa học dạng phân tử của phương trình ion rút gọn sau
Cu2+ + 2OH- → Cu(OH)2↓
Câu 3 (3.0 điểm). Trộn 150 ml dung dịch H2SO4 0,1M với 100 ml dung dịch BaCl2 0,1M thu được kết tủa trắng.
1. Viết phương trình phân tử và ion rút gọn.
2. Tính khối lượng kết tủa thu được.
3. Xác định các ion có trong dung dịch sau phản ứng (kèm số mol)
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 6
Phần I: Trắc nghiệm
Câu 1. B
Có 0,2V = 0,02 → V = 0,1 lít = 100 ml.
Câu 2. A
HClO ⇌ H+ + ClO-.
Câu 3. B
Do hai dung dịch HNO3 và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
Vậy dung dịch sau phản ứng có pH = 7.
Câu 4. A
CH3COOH ⇌ CH3COO- + H+
Do CH3COOH là chất điện li yếu nên [H+] < 0,10M.
Câu 5. A
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Câu 6. D
NaCl rắn, khan không dẫn được điện.
Câu 7. C
Ba(OH)2 là bazơ mạnh.
Câu 8. B
NaOH + HCl → NaCl + H2O
KOH + NaCl → không xảy ra phản ứng.
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O.
Câu 9. B
pOH = -log[OH-] = 2 → pH = 14 – pOH = 12.
Câu 10. D
Câu 11. C
Câu 12. D
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. D
[H+] = 10-pH = 10-3 = 0,001 (M).
Câu 14. D
Chất điện li mạnh gồm axit mạnh, bazơ mạnh và hầu hết các muối.
Câu 15. B
Câu 16. B
Phần II: Tự luận
Câu 1.
a. Na2SO4 → 2Na+ + SO42-
b. HCl → H+ + Cl-
c. HCOOH ⇌ HCOO- + H+.
Câu 2.
a. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
PT ion rút gọn: CO32- + 2H+ → CO2 + H2O
b. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Câu 3.
1. H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
PT ion rút gọn: Ba2+ + SO42- → BaSO4 ↓
2.
m↓ = 0,01.233 = 2,33 gam.
3. Dung dịch sau phản ứng gồm: SO42-: 0,005 mol; H+: 0,03 mol và Cl-: 0,02 mol.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 7)
Phần I: Trắc nghiệm
Câu 1. Chất không phân li ra ion khi hòa tan trong nước là
A. CaCl2.
B. HClO.
C. Ca(OH)2.
D. C2H5OH.
Câu 2. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 3. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 4. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 5. Để phân biệt dung dịch NH4Cl và dung dịch CuCl2 ta dùng dung dịch
A. HCl.
B. H2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 7. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 8. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 9. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
C. [H+] > [NO3-].
B. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 10. Trong dung dịch NH3 (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NH2-.
B. NH4+, OH-, H2O.
C. NH4+, OH-, NH3, H2O.
D. H+, OH-, NH3, H2O.
Câu 11. Dung dịch Ba(OH)2 có pH = 13 thì nồng độ của Ba(OH)2 là
A. 0,05M.
B. 0,1M.
C. 0,01M.
D. 0,005M.
Câu 12. Hợp chất thuộc loại chất điện li mạnh là
A. CH3COOCH3.
B. C2H5OH.
C. H2O.
D. KCl.
Câu 13. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 14. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 15. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 16: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. BaO + CO2 → BaCO3.
B. Zn + CuCl2 → ZnCl2 + Cu.
C. Ba(NO3)2 + 2KOH → Ba(OH)2 + 2KNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Phần II: Tự luận
Câu 1. (2 điểm) Viết phương trình điện li của các chất sau trong dung môi nước:
a. Ba(OH)2
b. CH3COOH
c. K2S
d. Zn(OH)2.
Câu 2. (2 điểm) Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau:
a. Ba(OH)2 + HCl →
b. CaCO3 + HNO3 →
Câu 3. (4 điểm) Dung dịch A có chứa: 0,01 mol M2+ ; 0,02 mol Al3+; 0,03 mol HCO32- và x mol Cl-. Khi cô cạn dung dịch A thu được 4,77 gam chất rắn khan.
a. Xác định giá trị của x và nguyên tố M.
b. Cho 300 ml dung dịch KOH 0,3M vào dung dịch A thu được m gam các chất kết tủa và dung dịch B. Xác định giá trị của m.
c. Nếu cô cạn dung dịch B sẽ thu được bao nhiêu gam chất rắn khan?
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 7
Phần I: Trắc nghiệm
Câu 1. C
C2H5OH không phân li ra ion khi hòa tan trong nước.
Câu 2. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 3. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 4. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 5. D
NH4+ + OH- → NH3↑ + H2O
Cu2+ + 2OH- → Cu(OH)2↓
Câu 6. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 7. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 8. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 9. A
Câu 10. C
NH3 + H2O ⇌ NH4+ + OH
Câu 11. A
[H+] = 10-13 → [OH-] = 0,1 (M).
Nồng độ của Ba(OH)2 là 0,05 (M)
Câu 12. D
KCl là muối tan nên là chất điện li mạnh.
Câu 13. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3- ⇌ H+ + CO32-.
Câu 14. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 15. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 16. D
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4↓
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai do không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Phần II: Tự luận
Câu 1.
a. Ba(OH)2 → Ba2+ + 2OH-
b. CH3COOH ⇌ CH3COO- + H+
c. K2S → 2K+ + S2-
d. Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ ZnO22- + 2H+.
Câu 2.
a. Ba(OH)2 + 2HCl → BaCl2 + 2H2O
PT ion rút gọn: H+ + OH- → H2O
b. CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 ↑ + H2O
PT ion rút gọn:
CaCO3 + 2H+ → Ca2+ + CO2 + H2O.
Câu 3.
a. Bảo toàn điện tích có: 0,01.2 + 0,02.3 = 0,03.2 + x
→ x = 0,02 (mol).
Bảo toàn khối lượng có:
mmuối = ∑mion → 0,01.MM + 0,02.27 + 0,03.96 + 0,02.35,5 = 4,77
→ MM = 64. Vậy kim loại M là Cu.
b. Cho KOH vào dung dịch A có các phản ứng:
Vậy kết tủa sau phản ứng gồm: Cu(OH)2: 0,01 mol và Al(OH)3: 0,01 mol
m = 0,01.98 + 0,01.78 = 1,76 gam.
c. Dung dịch B gồm:
SO42-: 0,03 mol; Cl-: 0,02 mol; AlO2-: 0,01 mol và K+: 0,09 mol.
Cô cạn dung dịch B được chất rắn có khối lượng:
m = 0,03.96 + 0,02.35,5 + 0,01.59 + 0,09.39 = 7,69 gam.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 8)
Câu 1: Một loại phân supephotphat kép chứa 69,62% muối canxi đihiđrophotphat, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân này là (Cho: Ca=40, P=31, O=16, H=1)
A. 39,76%.
B. 42,25%.
C. 45,75%.
D. 48,52%.
Câu 2: Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là oxit kim loại, khí nitơ đioxit và khí oxi?
A. Zn(NO3)2, KNO3, Pb(NO3)2.
B. Ca(NO3)2, LiNO3, KNO3.
C. Cu(NO3)2, Zn(NO3)2, Mg(NO3)2.
D. Hg(NO3)2, AgNO3.
Câu 3: Phân bón nitrophotka (NPK) là hỗn hợp của
A. (NH4)2HPO4 và NaNO3.
B. NH4H2PO4 và KNO3.
C. (NH4)3PO4 và KNO3.
D. (NH4)2HPO4 và KNO3.
Câu 4: Trong điều kiện thích hợp, photpho thể hiện tính oxi hóa trong phản ứng nào sau đây?
A. 2P + 5Cl2 → 2PCl5.
B. 2P + 3Mg → Mg3P2.
C. 4P + 5O2 → 2P2O5.
D. 6P + 5KClO3 → 3P2O5 + 5KCl
Câu 5: Dung dich axit yếu HF 0,1M có nồng độ ion H+ như thế nào?
A. =0,7M.
B. = 0,1M
C. < 0,1M
D. > 0,1M
Câu 6: Chất nào sau đây dẫn được điện?
A. H2O cất
B. C2H5OH
C. dd HCl
D. CaCl2 khan
Câu 7: Chất nào sau đây là chất điện li mạnh?
A. HF
B. Al2(SO4)3
C. CH3COOH
D. HNO2
Câu 8: Dung dịch Y chứa Ca2+ 0,1 mol, Mg2+, 0,3 mol, Cl- 0,4 mol, HCO3- x mol. Khi cô cạn dd Y thì khối lượng muối khan thu được là:
A. 25,4g
B. 49,8g
C. 30,5g.
D. 37,4g
Câu 9: Bao nhiêu chất sau đây là muối axit: KHCO3, NaHSO4, Ca(HCO3)2, Na2HPO3, BaCl2, NaHS, K2HPO4.
A. 7
B. 4
C. 5
D. 6
Câu 10: Cho 200 ml dung dịch KOH 0,3M tác dụng với 200 ml dung dịch HCl 0,1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch có pH bằng?
A. 13
B. 1
C. 2
D. 12
Câu 11: Bao nhiêu chất sau đây là axit nhiều nấc: HCl, H2SO4, HNO3, H2SO3, H3PO4, CH3COOH, HF, HBr?
A. 2
B. 3
C. 4
D. 5
Câu 12: Dung dịch X chứa HCl 0,004M và H2SO4 0,003M có pH bằng?
A. 1
B. 2,15
C. 3
D. 2
Câu 13: Chất nào sau đây là chất điện li yếu?
A. CH3COOH
B. H2SO4
C. KOH
D. NaCl
Câu 14: Chất nào sau đây là axit?
A. HCl
B. KHCO3
C. NaOH
D. K2CO3
Câu 15: Cho 200 ml dung dịch NaOH 0,1M tác dụng vừa đủ với 100 ml dung dịch HCl CM? Giá trị CM bằng?
A. 2M
B. 0,2M
C. 0,1M
D. 1M
Câu 16: Dãy các chất đều tác dụng được với dung dịch HNO3 đặc nóng là:
A. Cu, S, FeO, CuO.
B. Na2CO3, Al, Fe2(SO4)3, KCl.
C. Au, Mg(OH)2, Fe2O3, NaCl.
D. Ag, P, AlCl3, Na2SO4.
Câu 17: Hòa tan hỗn hợp X gồm 0,2 mol Fe và 0,15 mol Cu trong dung dịch HNO3 dư, sau phản ứng thu được NO (sản phẩm khử duy nhất). Số mol HNO3 phản ứng là
A. 1,0.
B. 0,5.
C. 0,6.
D. 1,2.
Câu 18: Trộn dung dịch chứa x mol H3PO4 với dung dịch chứa y mol KOH, sau khi phản ứng xảy ra hoàn toàn thu được 5,22 gam muối K2HPO4 và 4,24 gam K3PO4. Tỉ lệ x : y là (Cho: K=39, H=1, O=16, P=31)
A. 7:12.
B. 1:3.
C. 1:2.
D. 5:12
Câu 19: Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm:
A. FeO, NO2, O2.
B. Fe, NO2, O2.
C. Fe2O3, NO2, O2.
D. Fe2O3, NO2.
Câu 20: Phát biểu nào sau đây đúng?
A. Photpho đỏ độc, kém bền trong không khí ở nhiệt độ thường.
B. Khi làm lạnh, hơi của photpho trắng chuyển thành photpho đỏ.
C. Photpho đỏ có cấu trúc polime.
D. Photpho đỏ tan tốt trong các dung môi hữu cơ thông thường.
Câu 21: Trong điều kiện thích hợp, nitơ phản ứng được với tất cả các chất của dãy nào sau đây?
A. Li, H2, Al.
B. Fe, H2, Al.
C. H2, O2, Ag.
D. O2, Cu, Mg.
Câu 22: Phản ứng nhiệt phân nào dưới đây không đúng?
A. NH4Cl NH3 + HCl
B. NH4HCO3 NH3 +H2O+CO2
C. NH4NO3 NH3 +HNO3
D. NH4NO2 N2 +2H2O
Câu 23: Nung nóng Cu(NO3)2 một thời gian, để nguội, cân lại thấy khối lượng giảm 54 gam. Khối lượng Cu(NO3)2 đã bị nhiệt phân là (Cho: Cu=64, N=14, O=16)
A. 50 gam.
B. 49 gam.
C. 94 gam.
D. 98 gam.
Câu 24: Hòa tan 30 gam hỗn hợp X gồm Cu và CuO trong dung dịch HNO3 1M lấy dư, thu được 6,72 lít khí NO (đktc). Khối lượng CuO trong X là (Cho Cu=64, N=14, O=16)
A. 1,20 gam.
B. 4,25 gam.
C. 1,88 gam.
D. 2,52 gam.
Câu 25: Nếu thể tích các khí được đo trong cùng điều kiện, hiệu suất phản ứng là 25% thì thể tích của H2 và N2 cần lấy để điều chế 76,2 lít khí amoniac là (Cho : H=1, N=14)
A. 9,525 lít N2 và 28,575 lít H2.
B. 44,8 lít N2 và 134,4 lít H2.
C. 152,4 lít N2 và 457,2 lít H2.
D. 134,4 lít N2 và 403,2 lít H2.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 9)
Câu 1: Chọn câu phát biểu không đúng:
A. Phản ứng tổng hợp NH3 từ N2 và H2 là phản ứng thuận nghịch.
B. Nhỏ dung dịch NH3 đến dư vào dung dịch FeCl3thấy xuất hiện kết tủa màu nâu đỏ.
C. Nhiệt phân muối nitrat của kim loại luôn thu được kim loại và khí oxi.
D. Cho dd NaOH vào dung dịch CuSO4 thấy xuất hiện kết tủa màu xanh.
Câu 2: Xác định chất (A) và (B) trong chuỗi sau :
N2 NH3 (A) (B) HNO3
A. (A) là NO, (B) là N2O5
B. (A) là NO, (B) là NO2
C. (A) là N2, (B) là N2O5
D. (A) là N2, (B) là NO2
Câu 3: Hòa tan hết hỗn hợp X gồm 5,6 gam Fe; 27 gam Fe(NO3)2 và m gam Al trong dung dịch chứa 0,61 mol HCl. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa 47,455 gam muối trung hòa và 2,352 lít (đktc) hỗn hợp khí Z gồm NO và N2O. Tỉ khối của Z so với H2 là 16. Giá trị của m là
A. 1,080.
B. 4,185.
C. 5,400.
D. 2,160
Câu 4: Trong phòng thí nghiệm, khí oxi có thể thu được bằng cách nhiệt phân KNO3. Đem nhiệt phân hoàn toàn 15,15 gam KNO3 thu được bao nhiêu lít khí O2 (đktc)?
A. 1,86 lit
B. 3,36 lit
C. 2,24 lit
D. 1,68 lit
Câu 5: Tiến hành các thí nghiệm sau:
(1) Sục khí SO2 vào dung dịch H2S.
(2) Cho mẩu Na vào dung dịch CuSO4.
(3) Cho dung dịch AgNO3 vào dung dịch NaCl.
(4) Sục khí NH3 tới dư vào dung dịch AlCl3.
(5) Sục khí CO2 tới dư vào dd Ca(OH)2
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
A. 3.
B. 5.
C. 4.
D. 2.
Câu 6: : Để tạo độ xốp cho một số loại bánh, trong bột nở thường dùng muối nào sau đây?
A. (NH4)2SO4.
B. CaCO3.
C. NH4NO2.
D. NH4HCO3.
Câu 7: Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là kim loại, khí nitơ đioxit và oxi?
A. AgNO3.
B. Mg(NO3)2.
C. KNO3.
D. NH4NO3.
Câu 8: Cho 40 ml dd HCl 0,75M vào 160 ml Ba(OH)2 0,1M. pH dung dịch thu được là:
A. 2,5.
B. 0,96
C. 12.
D. 1.
Câu 9: Cho sơ đồ điều chế HNO3 trong phòng thí nghiệm:
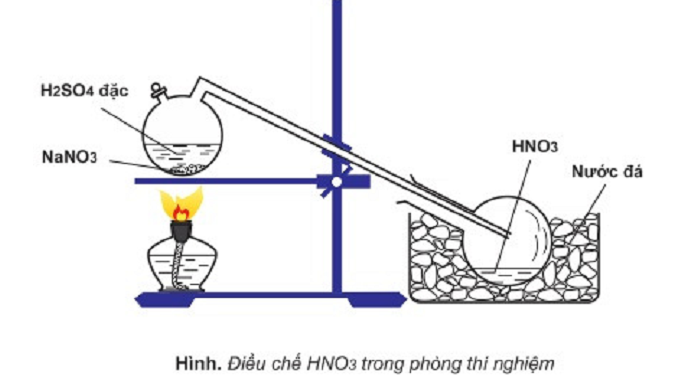
Phát biểu nào sau đây là sai khi nói về quá trình điều chế HNO3?
A. Đốt nóng bình cầu bằng đèn cồn để phản ứng xảy ra nhanh hơn.
B. HNO3 sinh ra dưới dạng hơi nên cần làm lạnh để ngưng tụ.
C. HNO3 là axit yếu hơn H2SO4 nên bị đẩy ra khỏi muối.
D. HNO3 có nhiệt độ sôi thấp (830C) nên dễ bị bay hơi khi đun nóng.
Câu 10: Cho các phản ứng hóa học sau:
(1) (NH4)2SO4 + BaCl2→
(2) CuSO4 + Ba(NO3)2→
(3) Na2SO4 + BaCl2→
(4) H2SO4 + BaSO3→
(5) (NH4)2SO4 + Ba(OH)2→
(6) Fe2(SO4)3 + Ba(NO3)2→
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (1), (2), (3), (6).
B. (1), (3), (5), (6).
C. (2), (3), (4), (6).
D. (3), (4), (5), (6).
Câu 11: Phản ứng trao đổi ion trong dung dịch các chất điện li xảy ra khi:
A. Tạo thành chất điện li yếu.
B. Có ít nhất một trong ba điều kiện trên
C. Tạo thành chất khí.
D. Tạo thành chất kết tủa.
Câu 12: Khối lượng kết tủa thu được khi trộn 10ml dung dịch Na2SO4 1M và 10 ml dung dịch BaCl2 1M là:
A. 1,79 gam
B. 2,33 gam
C. 3,94 gam
D. 4,39 gam
Câu 13: Chọn câu đúng
A. Giá trị pH tăng thì độ bazơ giảm
B. Dung dịch có pH >7 làm quỳ tím hoá xanh
C. Giá trị pH tăng thì độ axit tăng.
D. Dung dịch có pH >7 làm quỳ tím hoá đỏ.
Câu 14: Cho dd NaOH dư vào 300 ml dd NH4Cl 1,00 M, đun nóng nhẹ.Thể tích khí (đktc) thu được là:
A. 13,44 lít.
B. 6,72 lít.
C. 26,88 lít
D. 3,36 lít.
Câu 15: Phát biểu nào sau đây là khôngđúng?
A. Đốt cháy NH3 trong không khí (xúc tác Pt) tạo khí không màu hóa nâu ngoài không khí.
B. NH3 cháy trong oxi tỏa nhiều nhiệt nên được sử dụng là nhiên liệu tên lửa.
C. Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch NH3 thấy dung dịch chuyển sang màu hồng
D. Cho dung dịch NH3 từ từ vào dung dịch AlCl3 thấy xuất hiện kết tủa trắng không tan trong NH3.
Câu 16: Cho 100ml dung dịch Ba(OH)2 nồng độ 0,1Mvào 1 lít dung dịch (NH4)2CO30,01M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch giảm là
A. 2,31 gam.
B. 1,97 gam.
C. 2,14 gam.
D. 0,17 gam.
Câu 17: Cho 200 ml dd NaOH 0,1M vào 100 ml dd HCl 0,5M. Dung dịch thu được sau phản ứng làm:
A. Quỳ tím không đổi màu
B. Phenolphtalein không màu chuyển sang màu hồng
C. Quỳ tím hóa xanh
D. Quỳ tím hóa đỏ
Câu 18: Phát biểu nào sau đây đúng?
A. Khi tác dụng với kim loại hoạt động, N2 thể hiện tính khử.
B. Sấm chớp trong các trận mưa dông có thể tạo ra khí N2O do N2 tác dụng với O2.
C. Nitơ không duy trì sự hô hấp do nitơ là khí độc.
D. Vì phân tử N2 có liên kết ba rất bền nên ở nhiệt độ thường N2 khá trơ về mặt hóa học.
Câu 19: Chất nào sau đây là muối trung hòa?
A. Fe2(SO4)3
B. NaHCO3
C. KHSO4
D. NaH2PO4
Câu 20: Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi?
A. Cu(NO3)2, AgNO3, NaNO3.
B. KNO3, Hg(NO3)2, LiNO3.
C. Pb(NO3)2, Zn(NO3)2, Cu(NO3)2.
D. Mg(NO3)2, Fe(NO3)3, AgNO3
Câu 21: Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch, lượng muối clorua khan thu được là:
A. 6,26 gam.
B. 2,66 gam.
C. 26,6 gam.
D. 22,6 gam.
Câu 22: Hòa tan các chất sau: KOH, C2H5OH, C12H22O11, NaCl vào nước để thu được các dung dịch riêng rẽ. Trong các dung dịch thu được, có bao nhiêu dung dịch có khả năng dẫn điện?
A. 3
B. 2
C. 5
D. 6
Câu 23: Chất nào sau đây là chất điện li mạnh?
A. HNO2
B. HF
C. Al2(SO4)3
D. CH3COOH
Câu 24: Phương trình phản ứng nào dưới đây có phương trình ion rút gọn là: H+ + OH- → H2O :
A. NH4Cl + NaOH→ NH3 + H2O + NaCl
B. Mg(OH)2 + 2HNO3→ Mg(NO3)2+ 2H2O
C. NaOH + HNO3 → NaNO3 + H2O
D. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Câu 25: Dẫn khí NH3 vào nước thu được dung dịch có tính:
A. Bazo
B. Axit
C. Lưỡng tính
D. Trung tính
Câu 26: Cho 1,86 gam hỗn hợp Al và Mg tác dụng với dung dịch HNO3 loãng dư, thu được 560 ml lít khí N2O (đktc, sản phẩm khử duy nhất) bay ra. Khối lượng muối nitrat tạo ra trong dung dịch là
A. 40,5 gam.
B. 14,62 gam.
C. 24,16 gam.
D. 14,26 gam.
Câu 27: Dung dịch X gồm 0,1 mol K+, 0,2 mol Mg2+, 0,1 mol Na+, 0,2 mol Cl– và a mol Y2–. Cô cạn dung dịch X thu được m gam muối khan. Ion Y2– và giá trị của m là
A. SO42– và 56,5.
B. B. CO32– và 42,1.
C. CO32– và 30,1.
D. SO42– và 37,3.
Câu 28: Cho dãy các chất: (NH4)2CO3, Al(OH)3, Zn(OH)2, NaHCO3, Na2SO4. Số chất trong dãy vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH là
A. 5.
B. 4.
C. 3.
D. 2.
Câu 29: Cho các dd có cùng nồng độ mol: HNO3; CH3COOH; NaCl; NaOH. Dãy gồm các chất trên được sắp xếp theo thứ tự tăng dần độ pH là
A. HNO3; CH3COOH; NaCl; NaOH.
B. HNO3, CH3COOH; NaOH; NaCl.
C. HNO3; NaCl; CH3COOH; NaOH.
D. NaOH; NaCl; CH3COOH; HNO3
Câu 30: Nung 2,23 gam hỗn hợp X gồm các kim loại Fe, Al, Zn, Mg trong oxi, sau một thời gian thu được 2,71 gam hỗn hợp Y. Hoà tan hoàn toàn Y vào dung dịch HNO3(dư), thu được 0,672 lít khí NO (sản phẩm khử duy nhất, ở đktc). Số mol HNO3 đã phản ứng
A. 0,12.
B. 0,14.
C. 0,16.
D. 0,18.
Câu 31: Nung một lượng xác định muối Cu(NO3)2. Sau một thời gian dừng lại để nguội rồi đem cân thấy khối lượng giảm 54 gam. Khối lượng Cu(NO3)2 đã bị phân hủy là :
A. 69 gam.
B. 87 gam.
C. 94 gam.
D. 141 gam.
Câu 32: Axit HNO3 đặc, nguội không tác dụng với kim loại nào sau đây?
A. Fe
B. Cu
C. Ag
D. Zn
Câu 33: Số oxi hóa của N được xếp theo thứ tự tăng dần như sau :
A. N2 , NO , NH3 , NO2- , NO3-
B. NO , N2O , NH3 , NO3- , N2
C. NH3 , N2 , NH4+ , NO , NO2
D. NH3 , N2O , NO , NO2- , NO3-
Câu 34: Dãy các chất đều tác dụng với dung dịch Ba(OH)2 là:
A. NaHCO3, Na2CO3, CO2, MgSO4 , HCl
B. Mg(NO3)2, HCl, BaCl2, NaHCO3, Na2CO3
C. NaHCO3, Na2CO3, CO2, Mg(NO3)2, Ba(NO3)2
D. Ba(NO3)2, Mg(NO3)2, HCl, CO2, Na2CO3.
Câu 35: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít khí NO ở điều kiện tiêu chuẩn và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là
A. 8,88 gam.
B. 13,32 gam.
C. 6,52 gam.
D. 13,92 gam.
Câu 36: Hòa tan 32 g hỗn hợp Cu và CuO trong dung dịch HNO31M (dư), thoát ra 6,72 lít khí NO (đktc). Khối lượng CuO trong hỗn hợp ban đầu là :
A. 2,52g.
B. 1,88g.
C. 3,2g
D. 1,2g.
Câu 37: Trong 1,5 lít dung dịch có hòa tan 0,3 mol NaCl. Nồng độ mol/l của [Na+];[Cl-] lần lượt là:
A. 0,2M ; 0,2 M.
B. 0,1M ; 0,2M.
C. 0,1M ; 0,1M.
D. 0,3M ; 0,3M.
Câu 38: Có 4 dung dịch không màu: NH4Cl, (NH4)2SO4, BaCl2, Na2CO3 đựng trong 4 lọ mất nhãn riêng biệt. Dùng một dung dịch thuốc thử dưới đây để phân biệt 4 lọ trên
A. NaCl.
B. NH3.
C. NaNO3.
D. Ba(OH)2.
Câu 39: Dung dịch E chứa các ion Mg2+, SO42-, NH4+, Cl-. Chia dung dịch E ra 2 phần bằng nhau:
+ Phần I tác dụng với dung dịch NaOH dư, đun nóng, được 0,58 gam kết tủa và 0,672 lit khí (đktc).
+ Phần II tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa.
Tổng khối lượng các chất tan trong dung dịch E bằng
A. 3,055g.
B. 6,11g.
C. 5,35g.
D. 9,165g.
Câu 40: Cho V lít (đktc) hỗn hợp N2 và H2 có tỷ lệ mol 1:4 vào bình kín và đun nóng. Sau phản ứng được 1,5 mol NH3. Biết hiệu suất phản ứng là H = 25%. Giá trị của V là
A. 42 lít
B. 268,8 lít
C. 336 lít
D. 448 lít
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 10)
Phần I. Trắc nghiệm
Câu 1. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
C. [H+] > [NO3-].
B. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 2. Trong dung dịch NH3 (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NH2-.
B. NH4+, OH-, H2O.
C. NH4+, OH-, NH3, H2O.
D. H+, OH-, NH3, H2O.
Câu 3. Dung dịch Ba(OH)2 có pH = 13 thì nồng độ của Ba(OH)2 là
A. 0,05M.
B. 0,1M.
C. 0,01M.
D. 0,005M.
Câu 4. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 5. Để phân biệt dung dịch NH4Cl và dung dịch CuCl2 ta dùng dung dịch
A. HCl.
B. H2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 7. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 8. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 9. Chất không phân li ra ion khi hòa tan trong nước là
A. CaCl2.
B. HClO.
C. Ca(OH)2.
D. C2H5OH.
Câu 10. Hợp chất thuộc loại chất điện li mạnh là
A. CH3COOCH3.
B. C2H5OH.
C. H2O.
D. KCl.
Câu 11. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 12. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 13. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 14. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 15. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 16: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. BaO + CO2 → BaCO3.
B. Zn + CuCl2 → ZnCl2 + Cu.
C. Ba(NO3)2 + 2KOH → Ba(OH)2 + 2KNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Phần II. Tự luận
Câu 1. (4 điểm) Dung dịch A có chứa: 0,01 mol M2+ ; 0,02 mol Al3+; 0,03 mol HCO32- và x mol Cl-. Khi cô cạn dung dịch A thu được 4,77 gam chất rắn khan.
a. Xác định giá trị của x và nguyên tố M.
b. Cho 300 ml dung dịch KOH 0,3M vào dung dịch A thu được m gam các chất kết tủa và dung dịch B. Xác định giá trị của m.
c. Nếu cô cạn dung dịch B sẽ thu được bao nhiêu gam chất rắn khan?
Câu 2. (2 điểm) Viết phương trình điện li của các chất sau trong dung môi nước:
a. Ba(OH)2
b. CH3COOH
c. K2S
d. Zn(OH)2.
Câu 3. (2 điểm) Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau:
a. Ba(OH)2 + HCl →
b. CaCO3 + HNO3 →
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 11)
A. TRẮC NGHIỆM
Câu 1. Dãy các chất điện li mạnh gồm
A. BaCO3, KCl, CuCl2, AgNO3.
B. NaOH, HCl, NH4NO3, NaNO3.
C. CO2, FeSO4, KHCO3, Al(OH)3.
D. Fe(NO3)2, Ca3(PO4)2, HCl, CH3COOH.
Câu 2. Axit nitric và axit photphoric cùng có phản ứng với nhóm các chất sau:
A. H2SO4, KOH, NH3
B. NaOH, K2O, NH3
C. KCl, NaOH, NH3
D. NaCl, NaOH, NH3
Câu 3: Dung dịch gồm NaOH 0,2M và Ba(OH)2 0,1M có giá trị pH là
A. 13,6.
B. 0,4.
C. 0,5.
D. 13,5.
Câu 4. Thêm 0,15 mol NaOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng, trong dung dịch có các muối:
A). NaH2PO4 và Na2HPO4
B. NaH2PO4, Na2HPO4 và Na3PO4
C. Na2HPO4 và Na3PO4
D. NaH2PO4 và Na3PO4
Câu 5. Dung dịch X gồm các ion: Na+ (0,1M) ; Mg2+ (0,05 M); Cl- (0,06M) và ion SO42-. Nồng độ ion SO42- trong dung dịch là:
A. 0,07 M
B. 0,14 M
C. 0,05M
D. 0,06M
Câu 6. Tìm phản ứng nhiệt phân sai:
A. Zn(NO3)2ZnO + 2NO2 + 1/2O2
B. 2KNO32KNO2 + O2
C. 2AgNO3Ag2O + 2NO2 + 1/2O2
D. Mg(NO3)2MgO + 2NO2 + 1/2O2
Câu 7. Một dung dịch không thể chứa đồng thời các ion nào sau đây:
A. Al3+, K+, H+, NO3-, SO42-.
B. Fe3+, Cu2+, Na+,NH4+,Cl-
C. Mg2+, Ca2+, H+, OH-, Cl-, SO42-.
D. NH4+., K+, Na+, PO43-, CO32-
Câu 8: Dung dịch X gồm 0,15 mol K+; 0,3 mol Mg2+; 0,25 mol Na+; a mol Cl- và b mol SO42-. Cô cạn dung dịch X thu được 61,8 gam muối khan. Giá trị của b là
A. 0,4.
B. 0,3.
C. 0,2.
D. 0,5.
Câu 9: Trong số các chất sau: HNO2, CH3COOH, C6H6, HCOOH, C6H12O6, C2H5OH, NaClO, CH4, NaOH, NH4NO3 , H2S. Số chất thuộc loại chất điện li yếu là
A. 7.
B. 5.
C. 6.
D. 4.
Câu 10: Cho các chất sau: K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Ag; Cr(OH)3; Cu(OH)2; Al; Zn; CuS. Số chất tác dụng được với HCl là
A. 8.
B. 10.
C. 9.
D. 7.
B. TỰ LUẬN
Bài 1: Trộn 200ml dung dịch HNO3 0,02M với 300ml dung dịch NaOH 0,01M, được 500ml dung dịch A.
a. Viết phương trình phân tử, ion và rút gọn
b. Tính CM các ion trong dung dịch A
c. Tính pH trong dung dịch A
Bài 2: Nhận biết các dung dịch sau đây bằng phương pháp hóa học: NaCl, Na3PO4, NaNO3
Bài 3 Hòa tan hoàn toàn m gam Zn vào dung dịch HNO3 dư, thu được 313,6 ml khí NO2 (đktc, sản phẩm khử duy nhất). Tính giá trị của m.
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 11
A. Trắc nghiệm
Câu 1. B
Dãy các chất điện li mạnh gồm NaOH, HCl, NH4NO3, NaNO3.
Câu 2. B
Axit nitric và axit photphoric cùng có phản ứng với nhóm các chất NaOH, K2O, NH3
Câu 3. A
∑[OH-] = 0,2 + 0,1.2 = 0,4 (M)
pOH = -log[OH-] = 0,4 → pH = 14 – pOH = 13,6.
Câu 4: A
n OH- = 0,15 mol, n H3PO4 = 0,1 mol
k = => tạo hai muối: NaH2PO4 và Na2HPO4
Câu 5: A
BTDT: 0,1 +0,05.2= 0,06 + 2. n SO42-
nSO42- = 0,07
Câu 6: C
AgNO3Ag + NO2 + 1/2O2
Câu 7: C
Một dung dịch không thể chứa đồng thời các ion: Mg2+, Ca2+, H+, OH-, Cl-, SO42-
Câu 8. B
Bảo toàn điện tích có:
nk+ + 2.nMg2+ + nNa+ = nct- + 2.nSO42-
⇔ a + 2b + 1 (1)
Cô cạn dung dịch X có mmuối- = ∑mion → 35,a + 96b = 43 (2)
Từ (1) và (2) có: a = 0,4 và b = 0,3.
Câu 9. D
Các chất điện li yếu là: HNO2, CH3COOH, HCOOH, H2S.
Câu 10. C
Các chất tác dụng với HCl là K2CO3; (NH4)2CO3; Al(OH)3; Fe(OH)2; Zn(OH)2; Cr(OH)3; Cu(OH)2; Al; Zn;
B. Tự luận
Bài 1
a) NaOH + HNO3 NaNO3 + H2O
Na++ OH- + H+ + NO3- Na+ + NO3- + H2O
H+ + OH- H2O
nNa+ = nOH- = 0,003mol; nHH+ = n NO3- = 0,004mol
b) nH+ pư = nOH-pư = 0,003mol
sau phản ứng: nH+ = 0,001mol CM H+ = 0,002M
nNa+= 0,003mol CM Na+ =0,006M
n NO3- = 0,004mol CMNO3- = 0,008M
c) [H+] = 2.10-3M pH = 2,7
Bài 2: Thuốc thử: dung dịch AgNO3
Trích mỗi chất một ít cho vào ống nghiệm
Nhỏ dung dịch AgNO3 vào các ống nghiệm
+ Ống nghiệm nào xuất hiện kết tủa vàng → ống nghiệm chứa Na3PO4
Na3PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3
vàng
+ Ống nghiệm nào xuất hiện kết tủa trắng → ống nghiệm chứa NaCl
NaCl + AgNO3 → NaNO3 + AgCl↓ (↓trắng)
+ Ống nghiệm nào không có hiện tượng gì → ống nghiệm chứa NaNO3
Bài 3:
Số mol của NO2 = 0,3136/22,4 = 0,014 mol
PTHH: Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
0,007 0,014
Tính được số mol Zn = 0,007 mol
mZn = 0,007.65 = 0,455 gam.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 12)
Phần I: Trắc nghiệm: 2,5 điểm
Câu 1: Cho các chất sau: KOH, Ca(OH)2, Al(OH)3, Zn(OH)2, Sn(OH)2và Pb(OH)2. Số chất có tính chất lưỡng tính là:
A. 2.
B. 3
C. 4
D. 5
Câu 2: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là:
A. NH4+, NO3-, HCO3-, OH-
B. K+, H+, SO42-, OH-
C. Na+, NH4+, H+,CO32-
D. Ca2+, Fe2+, NO3-, Cl-
Câu 3: Cho phản ứng hóa học NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
A. 2KOH + FeCl2→ Fe(OH)2+ 2KCl
B. NaOH + NaHCO3→ Na2CO3+ H2O
C. NaOH + NH4Cl → NaCl + NH3+ H2O
D. KOH + HNO3→ KNO3+ H2O
Câu 4: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
![[Năm 2021] Đề thi Giữa kì 1 Hóa Học lớp 11 có đáp án (10 đề)](https://vietjack.com/de-kiem-tra-lop-11/images/de-thi-giua-ki-1-hoa-hoc-lop-11-co-dap-an-2021-26592.png)
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 5: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. CaO + CO2 → CaCO3.
B. Fe + CuCl2 → FeCl2 + Cu.
C. Ba(NO3)2 + 2NaOH → Ba(OH)2 + 2NaNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Câu 6: Quỳ tím hóa đỏ khi cho vào dung dịch có pH nào sau đây?
A. 7.
B. 8,5.
C. 2.
D. 9.
Câu 7: Phương trình điện li nào sau đây không đúng?
A. H2SO4 → 2H+ + SO42- .
B. CH3COOH ⇌ CH3COO- + H+ .
C. HF → H+ + F-.
D. KClO → K+ + ClO- .
Câu 8: Muối nào sau đây là muối axit?
A. NH4HCO3.
B. HCOONa.
C. HCOONH4.
D. (NH4)2CO3.
Câu 9: Cho 100ml dung dịch X chứa KOH 0,13M và Ba(OH)2 0,1M tác dụng với 200ml dung dịch H2SO4 x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
A. 0,03.
B. 0,09.
C. 0,06.
D. 0,045.
Câu 10: Một dung dịch có chứa các ion: NH4+ (0,1 mol), K+ (0,15 mol), NO3- (0,1 mol), và CO32- (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Phần II: Tự luận: 7,5 điểm
Câu 1: (2,0 điểm)
Chỉ dùng một hóa chất, hãy trình bày phương pháp hóa học phân biệt ba dung dịch sau đụng trong các lọ mất nhãn sau: NH4Cl, (NH4)2SO4và KNO3. Viết các phương trình hóa học xảy ra.
Câu 2: (2,0 điểm)
Viết phương trình phản ứng thực hiện dãy biến hóa sau (ghi rõ điều kiện nếu có)
NH4NO2→ N2→ NH3→ NO → NO2→ HNO3→ Cu(NO3)2→ O2
↓
Al(OH)3
Câu 3: (3,5 điểm)
Hòa tan hoàn toàn 23,6 gam hỗn hợp gồm Cu và Fe vào dung dịch HNO32M (dư), thu được dung dịch A và 7,84 lít khí NO (sản phẩm khử duy nhất ở đktc)
1. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp đầu.
2. Tính khối lượng muối khan thu được khi cô cạn dung dịch A.
3. Tính thể tích của dung dịch HNO3ban đầu (biết rằng dùng dư 10% so với lượng cần phản ứng)
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 12
Phần I: Trắc nghiệm
Câu 1: C
Số chất có tính chất lưỡng tính là : Al(OH)3, Zn(OH)2, Sn(OH)2và Pb(OH)2.
Câu 2: D
Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là: Ca2+, Fe2+, NO3-, Cl-
Câu 3: D
Phản ứng hóa học có cùng phương trình ion rút gọn :
KOH + HNO3→ KNO3+ H2O
Câu 4: B
Câu 5: D
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai vì không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Câu 6: C
Dung dịch có môi trường axit (pH < 7) làm quỳ tím chuyển sang màu đỏ.
Câu 7: C
HF là axit yếu, điện li thuận nghịch
Câu 8: A
Muối axit là muối mà gốc axit vẫn còn Hiđro có thể phân li ra ion H+.
→ NH4HCO3 là muối axit.
Câu 9: B
H+ + OH- → H2O
0,4x 0,033 mol
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H+ dư
→ 0,4x – 0,033 = 10-2.0,3 → x = 0,09.
Câu 10: B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
Ba2+ + CO32- → BaCO3↓
0,075 0,075 mol
m↓ = 0,075.197 = 14,775 gam.
Phần II: Tự luận
Câu 1
- Dùng dung dịch Ba(OH)2
- Trình bày lời đúng cho 1,0 điểm.
- Viết phương trình phản ứng đúng cho 1,0 điểm
Trích mẫu thử và đánh số thứ tự
Dùng dung dịch Ba(OH)2 để nhận biết 3 dung dịch trên. Cho từ từ dung dịch Ba(OH)2 vào 3 ống nghiệm đã được đánh số thứ tự
Ống nghiệm xuất hiện kết tủa trắng BaSO4 và sủi bột khí là ống nghiệm chứa (NH4)2SO4
Ba(OH)2 + (NH4)2SO4 → H2O + 2NH3 + BaSO4
Lọ có sủi bọt khí NH3 là NH4Cl
Ba(OH)2 + 2NH4Cl → 2H2O + 2NH3 + BaCl2
Không xuất hiên hiện tượng gì là KNO3
Câu 2: Mỗi phương trình đúng cho 0,25 điểm
N2 + 3H2 2NH3
4NH3 + 5O2 4NO + 6H2O
2NO + O2 2NO2
4NO2 + O2 + 2H2O → 4HNO3
2HNO3 + CuO → Cu(NO3)2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
CuO + CO Cu + CO2
Câu 3
1. 2,0 điểm.
- Viết phương trình phản ứng đúng cho0,5 điểm
- Lập hệ phương trình đúng cho0,5 điểm
- Giải hệ phương trình ra số mol Fe = 0,25 mol. Số mol Cu = 0,15 cho0,5 điểm
- Tính ra % Fe = 59,32%, % Cu = 40,68% cho0,5 điểm
2, Tìm ra khối lượng 2 muối = 88,7 gam. Cho0,75 điểm
3, Số mol HNO3 = 1,4 mol, thể tích HNO3 đủ = 0,7 lít, thể tích HNO3 dư 10% = 0,77 lít. Cho0,75 điểm
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 13)
Phần I: Trắc nghiệm
Câu 1. Chất không phân li ra ion khi hòa tan trong nước là
A. CaCl2.
B. HClO.
C. Ca(OH)2.
D. C2H5OH.
Câu 2. Hợp chất thuộc loại chất điện li mạnh là
A. CH3COOCH3.
B. C2H5OH.
C. H2O.
D. KCl.
Câu 3. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 4. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 5. Để phân biệt dung dịch NH4Cl và dung dịch CuCl2 ta dùng dung dịch
A. HCl.
B. H2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 7. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 8. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 9. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
C. [H+] > [NO3-].
B. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 10. Trong dung dịch NH3 (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NH2-.
B. NH4+, OH-, H2O.
C. NH4+, OH-, NH3, H2O.
D. H+, OH-, NH3, H2O.
Câu 11. Dung dịch Ba(OH)2 có pH = 13 thì nồng độ của Ba(OH)2 là
A. 0,05M.
B. 0,1M.
C. 0,01M.
D. 0,005M.
Câu 12. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 13. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 14. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 15. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 16: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. BaO + CO2 → BaCO3.
B. Zn + CuCl2 → ZnCl2 + Cu.
C. Ba(NO3)2 + 2KOH → Ba(OH)2 + 2KNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Phần II: Tự luận
Câu 1. (2 điểm) Viết phương trình điện li của các chất sau trong dung môi nước:
a. Ba(OH)2
b. CH3COOH
c. K2S
d. Zn(OH)2.
Câu 2. (2 điểm) Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau:
a. Ba(OH)2 + HCl →
b. CaCO3 + HNO3 →
Câu 3. (4 điểm) Dung dịch A có chứa: 0,01 mol M2+ ; 0,02 mol Al3+; 0,03 mol HCO32- và x mol Cl-. Khi cô cạn dung dịch A thu được 4,77 gam chất rắn khan.
a. Xác định giá trị của x và nguyên tố M.
b. Cho 300 ml dung dịch KOH 0,3M vào dung dịch A thu được m gam các chất kết tủa và dung dịch B. Xác định giá trị của m.
c. Nếu cô cạn dung dịch B sẽ thu được bao nhiêu gam chất rắn khan?
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 13
Phần I: Trắc nghiệm
Câu 1. C
C2H5OH không phân li ra ion khi hòa tan trong nước.
Câu 2. D
KCl là muối tan nên là chất điện li mạnh.
Câu 3. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3-⇌ H+ + CO32-.
Câu 4. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 5. D
NH4+ + OH- → NH3↑ + H2O
Cu2+ + 2OH- → Cu(OH)2↓
Câu 6. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 7. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 8. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 9. A
HNO3 → H+ + NO3-
0,1 0,1 mol
Câu 10. C
NH3 + H2O ⇌ NH4+ + OH
Câu 11. A
[H+] = 10-13 → [OH-] = 0,1 (M).
Nồng độ của Ba(OH)2 là 0,05 (M)
Câu 12. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 13. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 14. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 15. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 16. D
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4↓
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai do không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Phần II: Tự luận
Câu 1.
a. Ba(OH)2 → Ba2+ + 2OH-
b. CH3COOH ⇌ CH3COO- + H+
c. K2S → 2K+ + S2-
d. Zn(OH)2⇌ Zn2+ + 2OH-
Zn(OH)2⇌ ZnO22- + 2H+.
Câu 2.
a. Ba(OH)2 + 2HCl → BaCl2 + 2H2O
PT ion rút gọn: H+ + OH- → H2O
b. CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 ↑ + H2O
PT ion rút gọn:
CaCO3 + 2H+ → Ca2+ + CO2 + H2O.
Câu 3.
a. Bảo toàn điện tích có: 0,01.2 + 0,02.3 = 0,03.2 + x
→ x = 0,02 (mol).
Bảo toàn khối lượng có:
mmuối = ∑mion → 0,01.MM + 0,02.27 + 0,03.96 + 0,02.35,5 = 4,77
→ MM = 64. Vậy kim loại M là Cu.
b. Cho KOH vào dung dịch A có các phản ứng:
Al3+ + 3OH- → Al(OH)3↓
0,02 0,09 0,02 mol
Cu2+ + 2OH- → Cu(OH)2↓
0,01 0,03 0,01 mol
Sau đó còn OH- dư:
Al(OH)3↓ + OH- → AlO2- + 2H2O
0,02 0,01 mol
Vậy kết tủa sau phản ứng gồm: Cu(OH)2: 0,01 mol và Al(OH)3: 0,01 mol
m = 0,01.98 + 0,01.78 = 1,76 gam.
c. Dung dịch B gồm:
SO42-: 0,03 mol; Cl-: 0,02 mol; AlO2-: 0,01 mol và K+: 0,09 mol.
Cô cạn dung dịch B được chất rắn có khối lượng:
m = 0,03.96 + 0,02.35,5 + 0,01.59 + 0,09.39 = 7,69 gam.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 14)
Phần I: Trắc nghiệm
Câu 1. Phản ứng nào sau đây không xảy ra?
A. NaOH + HCl.
B. KOH + NaCl
C. NaOH + Cl2.
D. NaOH + Zn(OH)2.
Câu 2. pH của dung dịch KOH 0,01M là
A. 8.
B. 12.
C. 11.
D. 9.
Câu 3. Trộn hai thể tích bằng nhau của dung dịch HNO3 và dung dịch NaOH có cùng nồng độ mol/l. Giá trị pH của dung dịch sau phản ứng là
A. pH = 2.
B. pH = 7.
C. pH > 7.
D. pH < 7.
Câu 4. Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] < 0,10M.
B. [H+] = 0,10M.
C. [H+] < [CH3COO-].
D. [H+] > [CH3COO-].
Câu 5. Cho 5g NaCl vào dung dịch chứa 8,5g AgNO3 thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu 6. Chất nào sau đây là chất điện li mạnh
A. KClO4.
B. HCl.
C. KOH.
D. Cả A,B,C.
Câu 7. Theo A-rê-ni-ut, axit là
A. chất khi tan trong nước phân li ra anion H+.
B. chất khi tan trong nước phân li ra cation H+.
C. chất khi tan trong nước phân li ra anion OH-.
D. Tất cả đều sai.
Câu 8. Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd Ba(OH)2 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu 9. Chất nào sau đây là axit theo a – rê – ni – uyt?
A. HClO.
B. CsOH.
C. NH4Cl.
D. CH3COONa.
Câu 10. Ở 25°C, tích số K = [H+].[OH-] = 1,0.10-14 được gọi là
A. tích số tan của nước.
B. tích số phân li của nước.
C. độ điện li của nước .
D. tích số ion của nước.
Câu 11. Cụm từ nào sau đây còn thiếu trong dấu “…” ở câu sau: “Các dung dịch axit, bazơ, muối dẫn điện được là do trong dung dịch của chúng có các … chuyển động tự do”.
A. electron.
B. phân tử.
C. ion.
D. nguyên tử.
Câu 12. Phương trình ion rút gọn của phản ứng cho biết:
A. Không tồn tại phân tử trong dung dịch các chất điện li.
B. Nồng độ các trong dung dịch.
C. Các ion tồn tại trong dung dịch.
D. Bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. Một dung dịch có pH = 3. Nống độ ion H+ là
A. 0,003.
B. 0,01.
C. 0,1.
D. 0,001.
Câu 14. Chất nào sau đây không dẫn được điện?
A. NaCl nóng chảy.
B. CaCl2 nóng chảy.
C. HBr hoà tan trong H2O.
D. NaCl rắn, khan.
Câu 15. Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính?
A. Al(OH)3.
B. Cr(OH)3.
C. Ba(OH)2.
D. Pb(OH)2.
Câu 16. Muối axit là
A. Muối tạo bởi bazơ yếu và axit mạnh.
B. Muối vẫn còn hiđro có khả năng phân li ra cation H+.
C. Muối vẫn còn hiđro trong phân tử.
D. Muối có khả năng phản ứng với bazơ.
Phần II: Tự luận
Câu 1(1.5 điểm) Viết phương trình điện li của:
a) Na2SO4.
b) HCl.
c) HCOOH.
Câu 2 (1.5 điểm). Hoàn thành các phương trình hóa học sau:
a. Viết phương trình hóa học dạng ion rút gọn của phản ứng sau
Na2CO3 + HCl → ? + ? + ?
b. Viết một phương trình hóa học dạng phân tử của phương trình ion rút gọn sau
Cu2+ + 2OH- → Cu(OH)2↓
Câu 3 (3.0 điểm). Trộn 150 ml dung dịch H2SO4 0,1M với 100 ml dung dịch BaCl2 0,1M thu được kết tủa trắng.
1. Viết phương trình phân tử và ion rút gọn.
2. Tính khối lượng kết tủa thu được.
3. Xác định các ion có trong dung dịch sau phản ứng (kèm số mol)
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 14
Phần I: Trắc nghiệm
Câu 1. B
NaOH + HCl → NaCl + H2O
KOH + NaCl → không xảy ra phản ứng.
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O.
Câu 2. B
KOH → K+ + OH-
0,01 0,01 mol
pOH = -log[OH-] = 2 → pH = 14 – pOH = 12.
Câu 3. B
Do hai dung dịch HNO3 và NaOH có cùng thể tích và cùng nồng độ nên chúng có cùng số mol (x mol).
HNO3 + NaOH → NaNO3 + H2O
x x
Vậy dung dịch sau phản ứng có pH = 7.
Câu 4. A
CH3COOH ⇌ CH3COO- + H+
Do CH3COOH là chất điện li yếu nên [H+] < 0,10M.
Câu 5. A
NaCl + AgNO3 → AgCl↓ + NaNO3
0,086 0,05 0,05 mol
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Câu 6. D
Chất điện li mạnh gồm axit mạnh, bazơ mạnh và hầu hết các muối.
Câu 7. B
Câu 8. B
H+ + OH- → H2O
0,2V 0,02 mol
Có 0,2V = 0,02 → V = 0,1 lít = 100 ml.
Câu 9. A
HClO ⇌ H+ + ClO-.
Câu 10. D
Câu 11. C
Câu 12. D
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 13. D
[H+] = 10-pH = 10-3 = 0,001 (M).
Câu 14. D
NaCl rắn, khan không dẫn được điện.
Câu 15. C
Ba(OH)2 là bazơ mạnh.
Câu 16. B
Phần II: Tự luận
Câu 1.
a. Na2SO4 → 2Na+ + SO42-
b. HCl → H+ + Cl-
c. HCOOH ⇌ HCOO- + H+.
Câu 2.
a. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
PT ion rút gọn: CO32- + 2H+ → CO2 + H2O
b. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Câu 3.
1. H2SO4 + BaCl2 → BaSO4 ↓ + 2HCl
PT ion rút gọn: Ba2+ + SO42- → BaSO4 ↓
2.
Ba2 + SO42- → BaSO4↓
0,01 0,015 0,01 mol
m↓ = 0,01.233 = 2,33 gam.
3. Dung dịch sau phản ứng gồm: SO42-: 0,005 mol; H+: 0,03 mol và Cl-: 0,02 mol.
---------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 11
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 1 Hóa học lớp 11 có đáp án - (Đề số 15)
Phần I: Trắc nghiệm
Câu 1. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 2. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 3. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 4. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 5. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 6. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 7. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 8. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 9. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 10. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
B. [H+] > [NO3-].
C. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 11. Cho 5g NaCl vào dung dịch chứa 8,5g AgNO3 thì khối lượng kết tủa thu được sẽ là
A. 7,175g.
B. 71,8g.
C. 72,75g.
D. 73g.
Câu 12. Thể tích dung dịch HCl 0,2 M cần để trung hoà hết 100 ml dd Ba(OH)2 0,1 M là
A. 200 ml.
B. 100 ml.
C. 150 ml.
D. 50 ml.
Câu 13. Một dung dịch có pH = 3. Nống độ ion H+ là
A. 0,003.
B. 0,01.
C. 0,1.
D. 0,001.
Câu 14: Tiến hành các thí nghiệm sau:
(1) Sục khí H2S vào dung dịch FeSO4.
(2) Sục khí H2S vào dung dịch CuSO4.
(3) Sục khí SO2 vào dung dịch NaOH dư.
(4) Sục khí CO2 (dư) vào dung dịch Ca(OH)2.
(5) Sục H2S và dung dịch Ca(OH)2 dư.
(6) Nhỏ từ từ dung dịch K2CO3 vào dung dịch FeCl3.
(7) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
(8) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
Số thí nghiệm tạo ra kết tủa là
A. 4.
B. 5.
C. 6.
D. 7.
Câu 15: Cho 0,266 lít dung dịch X gồm NaOH 0,5M và Ba(OH)2 0,25M vào 140 ml dung dịch Al2(SO4)3 0,3 M thu được m gam kết tủa. Giá trị của m là
A. 5,46.
B. 20,9545.
C. 34,818.
D. 15,4945.
Phần II: Tự luận
Câu 1. Viết phương trình hóa học
a. Viết phương trình hóa học dưới dạng phân tử và ion rút gọn của phản ứng xảy ra sau: CaCO3 + HCl
b. Viết phương trình nhiệt phân các muối trong các trường hợp sau:
NH4NO3; Ca(NO3)2, MgCO3
c. Lập PTHH các phản ứng sau: ![]()
Câu 2: Hòa tan 21,60 gam hỗn hợp X ( gồm Fe và CuO ) bằng dung dịch HNO3 dư thu được dung dịch Y và 2,24 lít NO ( đktc) là sản phẩm khử duy nhất .
a) Viết phương trình hóa học xảy ra.
b) Xác định thành phần % của các chất trong hỗn hợp đầu hỗn hợp ban đầu.
Câu 3: Khi hòa tan hết 1,80 gam hỗn hợp A gồm Mg và Al trong dung dịch HNO3 loãng vùa đủ thu được hỗn hợp khí Y gồm 0,01mol N2 và 0,01mol N2O ( không có thêm sản phẩm khử khác) và dung dịch X. Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp đầu.
Đáp án đề thi Giữa học kì 1 môn Hóa học lớp 11 - Đề số 15
I. Phần trắc nghiệm (6đ)
Câu 1. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3- ⇌ H+ + CO32-.
Câu 2. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 3. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 4. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 5. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 6. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 7. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 8. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 9. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 10. A
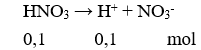
Câu 11. A
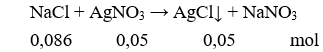
Vậy m↓ = 0,05.143,5 = 7,175 gam.
Câu 12. B
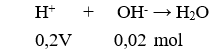
Có 0,2V = 0,02 → V = 0,1 lít = 100 ml.
Câu 13. D
[H+] = 10-pH = 10-3 = 0,001 (M).
Câu 14. A
(1) H2S + FeSO4 → không phản ứng.
(2) H2S + CuSO4 → CuS↓ + H2SO4.
(3) SO2 + 2NaOH dư → Na2SO3 + H2O
(4) 2CO2 dư + Ca(OH)2 → Ca(HCO3)2.
(5) H2S + Ca(OH)2 dư → CaS + 2H2O
(6) 3K2CO3 + 2FeCl3 + 3H2O→ 2Fe(OH)3↓ + 6KCl + 3CO2↑
(7) 6NH3 dư + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3(NH4)2SO4
(8) Ba2+ + SO42- → BaSO4↓
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 ↓ + OH- → AlO2- + 2H2O
Vậy các thí nghiệm (2); (6); (7); (8) tạo ra kết tủa.
Câu 15. B

Kết tủa sau phản ứng gồm:
BaSO4: 0,0665 mol và Al(OH)3: 0,084 – 0,014 = 0,07 mol.
m = 0,0665.233 + 0,07.78 = 20,9545 gam.
II. Phần tự luận
Câu 1:
a CaCO3+ 2HCl → CaCl2 + H2O + CO2 ↑
CaCO3+ 2H+ → Ca2+ + H2O + CO2 ↑
b. NH4NO3N2O + 2H2O
Ca(NO3)2 Ca(NO2)2 + O2
MgCO3 MgO + CO2
c. C + 4HNO3đặc CO2 +4NO2 +2H2O
Câu 2:
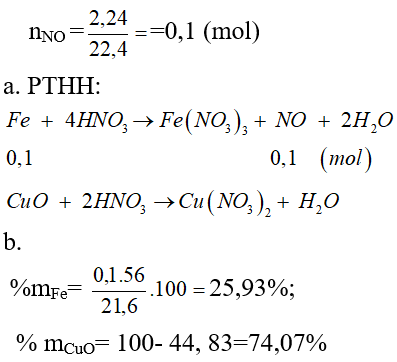
Câu 3:
Gọi nMg=x(mol); nAl= y(mol) (x,y>0)
Áp dụng định luật bảo toàn số mol e có hệ pt
2x+ 3y= 0,18
24x + 27y=1,8
Tìm ra x=0,03(mol) ; y=0,04 (mol).
%mMg= 40%; %mAl= 60 %.


