Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án
Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án
Bài tập về tính chất hóa học, phương pháp điều chế Halogen chọn lọc, có đáp án
-
A. Bài tập tự luận
-
Bài 1: Hãy giải thích: Vì sao người ta có thể điều chế hiđro clorua (HCl), hiđro florua (HF) bằng cách cho H2 SO4 đặc tác dụng với muối clorua hoặc florua. Nhưng không thể áp dụng phương pháp này để điều chế hiđro bromua (HBr), hoặc hiđro iotua (HI) ?
Hướng dẫn:
Có thể điều chế HCl và HF bằng phản ứng :
2NaCl + H2 SO4 → Na2 SO4 + HCl
CaF2 + H2 SO4 → CaSO4 + 2HF
Nhưng không áp dụng phương pháp trên điều chế HBr và HI vì HBr và HI có tính khử mạnh có thể phản ứng ngay với H2 SO4 :
2HBr + H2 SO4 → Br2 + SO2 + 2H2 O
8HI + H2 SO4 → 4 I2 + H2 S + 4H2 O
-
-
Bài 2. Viết 3 phương trình phản ứng chứng tỏ clo có tính oxi hóa, 2 phương trình phản ứng chứng tỏ clo có tính khử.
Hướng dẫn:
3 phương trình phản ứng chứng tỏ Clo có tính oxi hóa:
2Na + Cl2 → 2NaCl
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl
2 phương trình phản ứng chứng tỏ Clo có tính khử:
Cl + H2 O → HCl+ HClO ( Axit hipoclorơ)
Cl2 + 2NaOH → NaCl + NaClO + H2 O
Bài 3. a) Từ MnO2 , HCl đặc, Fe hãy viết các phương trình phản ứng điều chế Cl2 , FeCl2 và FeCl3 .
b) Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl2 , HCl và nước Javel .
Hướng dẫn
a, MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O
Fe + HCl → FeCl2 + H2 ↑
FeCl2 + 2Cl2 → 2FeCl3
b, 2NaCl + 2H2 O → H2 + 2NaOH + Cl2
Cl2 + H2 → 2HCl
Cl2 + NaOH → NaCl + NaClO + H2
Bài 4. Viết 1 phương trình phản ứng chứng tỏ axit HCl có tính oxi hóa, 1 phương trình phản ứng chứng tỏ HCl có tính khử.
Hướng dẫn:
HCl có tính oxi hóa
Fe + 2HCl → FeCl2 + H2
HCl có tính khử
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2 O

-
Bài 5. Viết 3 phương trình phản ứng điều chế sắt (III) clorua.
Hướng dẫn:
FeCl2 + 2Cl2 → 2FeCl3
2Fe + 3Cl2 → 2FeCl3
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Bài 6. Viết phương trình phản ứng xảy ra khi cho lần lượt các chất trong nhóm A {HCl, Cl2 } tác dụng với lần lượt các chất trong nhóm B {Cu, AgNO3 , NaOH, CaCO3 }.
Hướng dẫn:
Với HCl:
Cu + HCl → không xảy ra
AgNO3 + HCl → AgCl↓ + H2 O
NaOH + HCl → NaCl + H2 O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2 O
Với Cl2
Cu + Cl2 → CuCl2
AgNO3 + Cl2 → không xảy ra
2NaOH + Cl2 → NaCl + NaClO + H2 O
CaCO3 + Cl2 → không xảy ra
Bài 7. Axit HCl có thể tác dụng những chất nào sau đây? Viết phản ứng xảy ra: Al, Mg(OH) 2 , Na2 SO4 , FeS, Fe2 O3 , Ag2 SO4 , K2 O, CaCO3 , Mg(NO3 ) 2 .
Hướng dẫn:
2Al + 6HCl → 2AlCl3 + 3H2
Mg(OH) 2 + HCl → MgCl2 + H2 O
Na2 SO4 + HCl → không xảy ra
FeS + 2HCl → FeCl2 + H2S↑
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Ag2 SO4 + HCl → AgCl↓ + H2 SO4
K2 O + HCl → KCl + H2 O
CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2 O
Mg(NO3 ) 2 + HCl → không xảy ra
-
Bài 8. Vì sao clo ẩm có tính tẩy trắng còn clo khô thì không?
-
Hướng dẫn:
Cl + H2 O → HCl + HClO ( Axit hipoclorơ)
HClO có tính tẩy trắng
-
Bài 9: Cho dãy các chất sau, chất nào có khả năng tác dụng được với axit HCl? Viết phương trình hóa học của phản ứng xảy ra, ghi rõ điều kiện của phản ứng: Fe, FeCl2 , FeO, Fe2 O3 , Fe3 O4 , KMnO4 , Cu, AgNO3 , H2 SO4 , Mg(OH) 2 .
Hướng dẫn:
Các chất có thể tác dụng với axit HCl là: Fe, FeO, Fe2 O3 , Fe3 O4 , KMnO4 , AgNO3 , Mg(OH) 2 .
PTHH:
Fe + 2HCl → FeCl2 + H2
FeO + 2HCl → FeCl2 + H2 O
Fe2 O3 + 6HCl → 2FeCl3 + 3H2 O
Fe3 O4 + 8HCl → FeCl2 +2FeCl3 + 4H2 O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2 O
AgNO3 + HCl → AgCl + HNO3
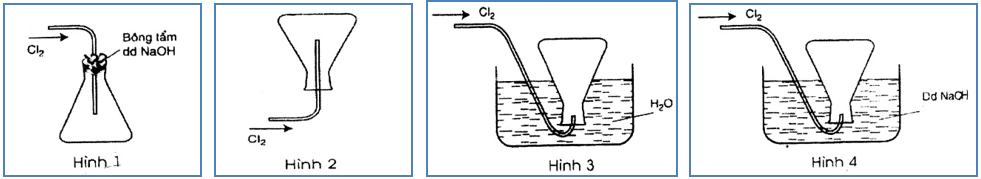
Bài 10: Trong các hình vẽ mô tả cách thu khí clo sau đây, hình vẽ nào mô tả đúng cách thu khí clo trong phòng thí nghiệm? Giải thích?
Đáp án: Hình 1.
Giải thích
- Do khí Cl2 nặng hơn không khí nên người ta để ngửa bình (Cl2 nặng hơn không khí sẽ nằm ở dưới nó đẩy không khí có chứa sẵn trong bình ra khỏi bình và chiếm chỗ).
- Dùng bông có tẩm dung dịch NaOH để cho không khí đi ra ngoài và khi bình đầy khí Cl2 thì Cl2 sẽ bị giữ lại trong bình không thoát ra ngoài được do 1 phần nó pứ với NaOH và phần này bị mất đi gọi là hao phí trong quá trình điều chế.
- Không sử dụng phương pháp đẩy nước do Cl tan trong nước.
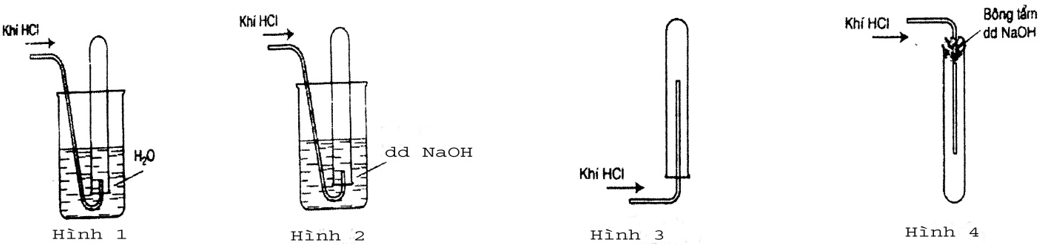
Bài 11: Trong các hình vẽ sau, hình vẽ nào mô tả đúng nhất cách thu khí HCl trong phòng thí nghiệm?
Đáp án Hình 4 (HD: Do HCl nặng hơn không khí nên để ngửa ống nghiệm. HCl tan nhiều trong nước nên không sử dụng phương pháp đẩy nước.)
Bài 12: Vì sao người ta có thể điều chế các halogen: Cl2 , Br2 , I2 bằng cách cho hỗn hợp H2 SO4 đặc và MnO2 tác dụng với muối clorua, bromua, iotua nhưng phương pháp này không thể áp dụng điều chế F2 ? Bằng cách nào có thể điều chế được flo (F2 ) ? Viết phương trình phản ứng điều chế Flo.
Hướng dẫn:
Do F có tính oxi hóa rất mạnh nên phương pháp duy nhất để diều chế F là dùng dòng điện để oxi hóa ion F-trong florua nóng chảy (PP điện phân).
PTHH Điện phân hỗn hợp KF và HF:
2HF → H2 + F2
(KF)
Bài 13: Từ NaCl, MnO2 , H2 SO4 đặc, Zn, H2 O. Hãy viết phương trình hóa học để điều chế khí hiđroclorua và khí Clo bằng 2 cách khác nhau?
Hướng dẫn:
MnO2 + 4HCl
MnCl2 + Cl2 ↑ + 2H2 O
2NaCl + 2H2 O
H2 ↑ + 2NaOH + Cl2 ↑
2NaCltt + H2 SO4
Na2 SO4 + 2HCl↑
H2 + Cl2 → 2HCl
B. Bài tập trắc nghiệm
-
Câu 1: Trong phòng thí nghiệm người ta thường điều chế clo bằng cách
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl có màng ngăn.
C. phân huỷ khí HCl.
D. cho HCl đặc tác dụng với MnO2 ; KMnO4…
Câu 2: Cho 4 đơn chất F2 ; Cl2 ; Br2 ; I2. Chất có nhiệt độ sôi cao nhất là :
A. F2. B. Cl2. C. Br2. D. I2.
Câu 3: Halogen ở thể rắn (điều kiện thường), có tính thăng hoa là :
A. flo. B. clo. C. brom. D. iot.
Câu 4: Hãy chỉ ra mệnh đề không chính xác :
A. Tất cả muối AgX (X là halogen) đều không tan trong nước.
B. Tất cả các hiđro halogenua đều tồn tại ở thể khí, ở điều kiện thường.
C. Tất cả các hiđro halogenua khi tan vào nước đều cho dung dịch axit.
D. Các halogen (từ F2 đến I2) tác dụng trực tiếp với hầu hết các kim loại.
Câu 5: Dãy nào được xếp đúng thứ tự tính axit và tính khử giảm dần ?
A. HCl, HBr, HI, HF. B. HI, HBr, HCl, HF.
C. HCl, HI, HBr, HF. D. HF, HCl, HBr, HI.
Câu 6: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là :
A. Cl2, H2O. B. HCl, HClO.
C. HCl, HClO, H2O. D. Cl2, HCl, HClO, H2O.
Câu 7: Trong PTN, Cl2 thường được điều chế theo phản ứng :
HCl đặc + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng của HCl là :
A. 4. B. 8. C. 10. D. 16.
Câu 8: Trong tự nhiên, các halogen
A. chỉ tồn tại ở dạng đơn chất.
B. chỉ tồn tại ở dạng muối halogenua.
C. chỉ tồn tại ở dạng hợp chất.
D. tồn tại ở cả dạng đơn chất và hợp chất.
Câu 9: Cho các phản ứng sau :
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn → ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là :
A. 2. B. 4. C. 1. D. 3.
Câu 10: Dãy nào được xếp đúng thứ tự tính axit giảm dần và tính oxi hoá tăng dần ?
A. HClO, HClO3, HClO2, HClO4. B. HClO4, HClO3, HClO2, HClO.
C. HClO, HClO2, HClO3, HClO4. D. HClO4, HClO2, HClO3, HClO.
Câu 11: Clorua vôi, nước Gia-ven (Javel) và nước clo thể hiện tính oxi hóa là do
A. chứa ion ClO-, gốc của axit có tính oxi hóa mạnh.
B. chứa ion Cl-, gốc của axit clohiđric điện li mạnh.
C. đều là sản phẩm của chất oxi hóa mạnh Cl2 với kiềm.
D. trong phân tử đều chứa cation của kim loại mạnh.
Câu 12: Phương pháp duy nhất để điều chế Flo là :
A. Cho dung dịch HF tác dụng với MnO2.
B. Điện phân nóng chảy hỗn hợp NaF và NaCl.
C. Điện phân nóng chảy hỗn hợp KF và HF.
D. Cho Cl2 tác dụng với NaF.
-