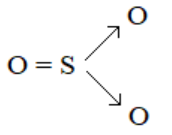5 dạng bài tập Liên kết hóa học trong đề thi Đại học có lời giải
5 dạng bài tập Liên kết hóa học trong đề thi Đại học có lời giải Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được 5 dạng bài tập Liên kết hóa học trong đề thi Đại học có lời giải
5 dạng bài tập Liên kết hóa học trong đề thi Đại học có lời giải
-
Dạng 1: Giải thích sự hình thành liên kết ion
Phương pháp giải
+ Liên kết ion được tạo thành từ kim loại và phi kim:
Kim loại – e → Cation
Phi kim + e → Anion
+ Giữa anion và cation tạo thành có lực hút tĩnh điện và tạo thành liên kết ion
+ Hiệu độ ấm điện giữa 2 nguyên tố liên kết thường ≥ 1,7

- Ví dụ minh họa
Ví dụ 1: Có 2 nguyên tố X ( Z = 19); Y (Z =17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
A. XY, liên kết ion
B. X2Y, liên kết ion
C. XY, liên kết cộng hóa trị có cực
D. XY2, liên kết cộng hóa trị có cực
Hướng dẫn giải:
Cấu hình e:
X: [Ar]4s1 ⇒ X thuộc nhóm IA
Y: [Ne]3s23p5 ⇒ Y thuộc nhóm VIIA
Ta có: X – 1e → X+
Y + 1e → Y-
⇒ Hợp chất tạo bởi X và Y là XY và liên kết ion
⇒ Đáp án C
Ví dụ 2: Dãy nào sau đây không chứa hợp chất ion ?
A. NH4Cl, OF2, H2S.
B. CO2, Cl2, CCl4.
C. BF3, AlF3, CH4.
D. I2, CaO, CaCl2.
Hướng dẫn giải:
+ Đáp án A: Hợp chất ion NH4Cl
+ Đáp án C: Hợp chất ion BF3, AlF3
+ Đáp án D: Hợp chất ion CaCl2
⇒ Đáp án B
Ví dụ 3: Cho các hợp chất: NH3, H2O, K2S, MgCl2, Na2O, CH4. Chất có liên kết ion là:
A. NH3, H2O, K2S, MgCl2
B. K2S, MgCl2, Na2O, CH4
C. NH3, H2O, Na2O, CH4
D. K2S, MgCl2, Na2O
Hướng dẫn giải:
⇒ Đáp án D
Ví dụ 4: X, Y, Z là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19, 8.
1. Viết cấu hình electron nguyên tử của các nguyên tố đó. Cho biết tính chất hóa học đặc trưng của X, Y, Z.
2. Dự đoán liên kết hóa học có thể có giữa các cặp X và Y, Y và Z, X và Z. Viết công thức phân tử của các hợp chất tạo thành.
Hướng dẫn giải:
1. Cấu hình electron của các nguyên tử X, Y, Z:
X: (Z = 9) : 1s2 2s2 2p5
Y: (Z = 19) : 1s2 2s2 2p6 3s2 3p6 4s1
Z: (Z = 8) : 1s2 2s2 2p4
Tính chất đặc trưng của Y là tính kim loại, của X và Z là tính phi kim.
2. Liên kết giữa X và Y, giữa Y và Z là liên kết ion.
- Sự hình thành liên kết giữa X và Y:
X + 1e → X-
Y → Y+ + 1e
Các ion Y+ và X- hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất YX.
- Sự hình thành liên kết giữa Y và Z:
Z + 2e → Z2-
2Y → 2Y+ + 21e
Các ion Y+ và Z2- hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất Y2Z.
- X và Z là các phi kim nên liên kết giữa chúng là liên kết cộng hóa trị. Để đạt được cấu hình bền vững, mỗi nguyên tử X cần góp chung 1e, mỗi nguyên tử Z cần góp chung 2e. Như vậy 2 nguyên tử X sẽ tham gia liên kết với 1 nguyên tử Z bằng 2 liên kết cộng hóa trị đơn nhờ 2 cặp electron góp chung. Do đó công thức phân tử của hợp chất là X2Z.
-
Ví dụ 5: Hợp chất trong phân tử có liên kết ion là :
A. NH4Cl. B. HCl.
C. NH3. D. H2O.
Hướng dẫn giải:
Liên kết giữa cation NH4+ và anion Cl-
⇒ Đáp án A
-
Dạng 2: Giải thích sự hình thành của liên kết cộng hóa trị
Phương pháp giải
+ Liên kết cộng hóa trị được hình thành bằng cặp electron chung
- Cặp e dùng chung phân bố đối xứng giữa hai hạt nhân nguyên tử tham gia liên kết thì đó là liên kết cộng hóa trị không phân cực.
- Khi cặp e dùng chung bị hút về nguyên tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
+ Hiệu độ âm điện trong liên kết cộng hóa trị:
- Hiệu độ âm điện của 2 nguyên tử trong liên kết cộng hóa trị không cực: Từ 0 đến nhỏ hơn 0,4
- Hiệu độ âm điện của 2 nguyên tử trong liên kết cộng hóa trị có cực: Từ 0,4 đến nhỏ hơn 1,7
Ví dụ minh họa
Ví dụ 1: Giống nhau giữa liên kết cộng hóa trị và liên kết kim loại là :
A. Đều có những cặp electron dùng chung.
B. Đều tạo thành từ những electron chung giữa các nguyên tử.
C. Đều là những liên kết tương đối kém bền.
D. Đều tạo thành các chất có nhiệt độ nóng chảy thấp.
Hướng dẫn giải:
⇒ Đáp án B
Ví dụ 2: Dãy phân tử nào cho dưới đây đều có liên kết cộng hoá trị không phân cực ?
A. N2, CO2, Cl2, H2.
B. N2, Cl2, H2, HCl.
C. N2, HI, Cl2, CH4.
D. Cl2, O2, N2, F2.
Hướng dẫn giải:
⇒ Đáp án D
Ví dụ 3: Cho các oxit : Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Dãy các hợp chất trong phân tử chỉ gồm liên kết cộng hoá trị là :
A. SiO2, P2O5, SO3, Cl2O7.
B. SiO2, P2O5, Cl2O7, Al2O3.
C. Na2O, SiO2, MgO, SO3.
D. SiO2, P2O5, SO3, Al2O3.
Hướng dẫn giải:
⇒ Đáp án A
Ví dụ 4: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử
A. phi kim, được tạo thành do sự góp chung electron.
B. khác nhau, được tạo thành do sự góp chung electron.
C. được tạo thành do sự góp chung một hay nhiều electron.
D. được tạo thành từ sự cho nhận electron giữa chúng.
Hướng dẫn giải:
⇒ Đáp án
-
Ví dụ 5: Các chất trong dãy nào sau đây chỉ có liên kết cộng hoá trị phân cực ?
A. HCl, KCl, HNO3, NO.
B. NH3, KHSO4, SO2, SO3.
C. N2, H2S, H2SO4, CO2.
D.CH4, C2H2, H3PO4, NO2.
Hướng dẫn giải:
Dựa vào hiệu độ âm điện
⇒ Đáp án D
-
Dạng 3: Xác định trạng thái lai hóa
Phương pháp giải
+ Lai hóa sp
- Là sự tổ hợp 1 obitan s với 1 obitan p tạo thành 2 obitan lai hóa sp.
- 2 obitan sp này nằm thẳng hàng với nhau, hướng về 2 phía, đối xứng nhau.
- Góc liên kết bằng 180o.
+ Lai hóa sp2
- Là sự tổ hợp 1 obitan s với 2 obitan p tạo thành 3 obitan lai hóa sp2.
- 3 obitan sp2này nằm trong 1 mặt phẳng, định hướng từ tâm đến đỉnh của tam giác đều.
- Góc liên kết bằng 120o.
+ Lai hóa sp3
- Là sự tổ hợp 1 obitan s với 3 obitan p tạo thành 4 obitan lại hóa sp3.
- Định hướng từ tâm đến 4 đỉnh của hình tứ diện đều.
- Các trục đối xứng của chúng tạo với nhau 1 góc 109o28'.
Ví dụ minh họa
Ví dụ 1: Cho các phân tử sau : C2H2 (1) ; BF3 (2) ; BeCl2 (3) ; C2H4 (4) ; CH4 (5) ; Cl2 (6) ; H2 (7) ; H2O (8) ; NH3 (9) ; HCl (10). Trong các phân tử trên, sự hình thành liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là :
A. (1), (3), (6). B. (1), (2), (3), (5).
C. (1), (3), (4), (7). D. (1), (3).
Hướng dẫn giải:
⇒ Đáp án D
b. Sự lai hoá sp2 các AO hoá trị là :
A. (2), (4). B. (2), (6).
C. (2), (3), (4). D. A, B, C.
Hướng dẫn giải:
⇒ Đáp án A
b. Sự lai hoá sp3 các AO hoá trị là :
A. (5), (6), (8), (10). B. (5), (8), (9).
C. (3), (5), (8), (9). D. (5), (6), (8), (9).
Hướng dẫn giải:
⇒ Đáp án B
Ví dụ 2: Trong mạng tinh thể kim cương, góc liên kết tạo bởi các nguyên tử cacbon là :
A. 90o. B. 120o.
C. 104o30'. D. 109o28'.
Hướng dẫn giải:
C (kim cương) có lại hóa sp3
⇒ Đáp án D
Dạng 4: Viết công thức cấu tạo của các phân tử
Phương pháp giải
Viết cấu hình e của các nguyên tử tạo hợp chất:
Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp nc
Công thức electron : Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí hiệu nguyên tử
Công thức cấu tạo: Thay mỗi cặp e chung bằng 1 gạch ngang
Ví dụ minh họa
Ví dụ 1: R là một nguyên tố phi kim. Tổng đại số số oxi hóa dương cao nhất với 2 lần số oxi hóa âm thấp nhất của R là +2. Tổng số proton và nơtron của R nhỏ hơn 34.
1. Xác định R
2. X là hợp chất khí của R với hiđro, Y là oxit của R có chứa 50% oxi về khối lượng. Xác định công thức phân tử của X và Y.
3. Viết công thức cấu tạo các phân tử RO2; RO3; H2RO4.
Hướng dẫn giải:
1. Gọi số oxi hóa dương cao nhất và số oxi hóa âm thấp nhất của R lần lượt là +m và -n.
Số oxi hóa cao nhất của R trong oxit là +m nên ở lớp ngoài cùng nguyên tử R có m electron.
Số oxi hóa trong hợp chất của R với hiđro là -n nên để đạt được cấu hình 8 electron bão hòa của khí hiếm, lớp ngoài cùng nguyên tử R cần nhận thêm n electron.
Ta có: m + n = 8. Mặt khác, theo bài ra: +m + 2(-n) = +2 m - 2n = 2.
Từ đây tìm được: m = 6 và n = 2. Vậy R là phi kim thuộc nhóm VI.
Số khối của R < 34 nên R là O hay S. Do oxi không tạo được số oxi hóa cao nhất là +6 nên R là lưu huỳnh.
2. Trong hợp chất X, S có số oxi hóa thấp nhất nên X có công thức phân tử là H2S.
Gọi công thức oxit Y là SOn.
Do %S = 50% nên n = 2. Công thức phân tử của Y là SO2.
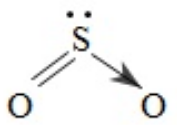
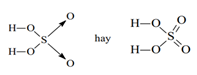
3. Công thức cấu tạo của SO2; SO3; H2SO4:
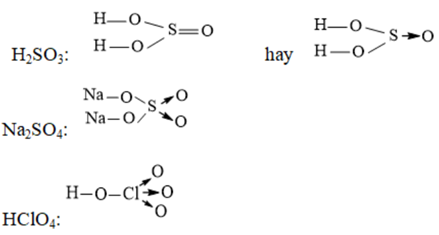
Ví dụ 2: Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4
Hướng dẫn giải:
Dạng 5: Xác định hóa trị và số oxi hóa
Phương pháp giải
Hóa trị:
- Hợp chất ion:
+ Người ta quy ước , khi viết điện hóa trị của nguyên tố , ghi giá trị điện tích trước, dấu của điện tích sau
+ Các nguyên tố kim loại thuộc nhóm IA , IIA , IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+ , 2+ , 3+
+ Các nguyên tố phi kim thuộc nhóm VIA , VIIA nên có 6, 7 electron lớp ngoài cùng , có thể nhận thêm 2 hay 1 electron vào lớp ngoài cùng , nên có điện hóa trị 2– , 1–
- Hợp chất cộng hóa trị:
+ Trong các hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết cộng hóa trị của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó
Số oxi hóa:
Quy tắc 1 : SOXH của các nguyên tố trong các đơn chất bằng không
Quy tắc 2 : Trong 1 phân tử, tổng số SOXH của các nguyên tố bằng 0
Quy tắc 3 : SOXH của các ion đơn nguyên tử bằng điện tích của ion đó . Trong ion đa nguyên tử , tổng số SXOH của các nguyên tố bằng điện tích của ion
Quy tắc 4 : Trong hầu hết các hợp chất, SOXH của H bằng +1 , trừ 1 số trường hợp như hidru, kim loại (NaH , CaH2...). SOXH của O bằng –2 trừ trường hợp OF2, peoxit (chẳng hạn H2O2,...)
Lưu ý: SOXH được viết bằng chữ số thường dấu đặt phía trước và được đặt ở trên kí hiệu nguyên tố
Ví dụ minh họa
-
Ví dụ 1: Cộng hóa trị của nitơ trong các chất: N2, NH3, N2H4, NH4Cl, NaNO3 tương ứng là :
A. 0, –3, –2, –3, +5. B. 0, 3, 2, 3, 5.
C. 2, 3, 0, 4, 5. D. 3, 3, 3, 4, 4.
Hướng dẫn giải:
⇒ Đáp án D
Ví dụ 2: Cộng hóa trị của Cl và O trong Cl2O7 theo thứ tự là :
A. 7 và 2. B. 2 và 7.
C. 4 và 1. D. 1 và 2.
Hướng dẫn giải:
⇒ Đáp án A
Ví dụ 3: Cộng hóa trị của N trong phân tử HNO3 và NH4+ (theo thứ tự) là :
A. 5 và 4. B. 4 và 4.
C. 3 và 4. D. 4 và 3
Hướng dẫn giải:
⇒ Đáp án B
Ví dụ 4: Cộng hoá trị của C và N trong CH4 và NH3 lần lượt là :
A. 2 và 4. B. 4 và 3.
C. 3 và 3. D. 1 và 4.
Hướng dẫn giải:
⇒ Đáp án B
Ví dụ 5: Cộng hoá trị của O và N2 trong H2O và N2 lần lượt là :
A. 2 và 3. B. 4 và 2.
C. 3 và 2. D. 1 và 3.
Hướng dẫn giải:
⇒ Đáp án A
-
-
Ví dụ 6: Điện hóa trị của Mg và Cl trong MgCl2 theo thứ tự là :
A. 2 và 1. B. 2+ và 1–.
C. +2 và –1. D. 2+ và 2–
Hướng dẫn giải:
⇒ Đáp án B
-
Ví dụ 7: Cộng hoá trị lớn nhất của một nguyên tố có cấu hình electron ngoài cùng 3s23p4 là :
A. 2. B. 3.
C. 4. D. 6.
Hướng dẫn giải:
⇒ Đáp án D