Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M
Lời giải bài 4* trang 98 Hóa học 10 sách Cánh Diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Cánh Diều Bài 16: Tốc độ phản ứng hóa học
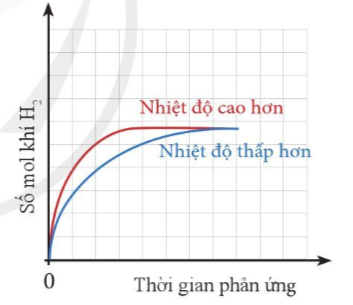
Bài 4* trang 98 Hóa học 10: Cùng một lượng kim loại Zn phản ứng với cùng một thể tích dung dịch H2SO4 1M, nhưng ở hai nhiệt độ khác nhau.
Zn + H2SO4 → ZnSO4 + H2
Thể tích khí H2 sinh ra ở mỗi thí nghiệm theo thời gian được biểu diễn ở đồ thị bên.
a) Giải thích vì sao đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh.
b) Vì sao sau một thời gian, hai đường đồ thị lại chụm lại với nhau?
Lời giải:
a) Đồ thị màu đỏ ban đầu cao hơn đồ thị màu xanh do: Nhiệt độ càng cao, tốc độ phản ứng càng lớn, khí thoát ra càng nhiều.
b) Sau một thời gian, hai đồ thị lại chụm lại với nhau do phản ứng đã dừng lại (một hoặc cả hai các chất tham gia phản ứng hết). Do cùng lượng kim loại và H2SO4 cùng thể tích, nồng độ nên lượng khí thu được là như nhau ở cả 2 trường hợp.
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Cánh Diều hay, chi tiết khác:


