Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả hình thành liên kết
Lời giải câu hỏi 3 trang 58 Hóa học 10 sách Cánh Diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Cánh Diều Bài 11: Liên kết cộng hóa trị
Câu hỏi 3 trang 58 Hóa học 10: Nguyên tử fluorine (F) có cấu hình electron là [He]2s22p5. Khi các nguyên tử F liên kết với nhau, để thỏa mãn quy tắc octet, một bạn học sinh đề xuất như sau: Một nguyên tử F nhường 7 electron, tạo ion F7+ có cấu hình là [He]; 7 nguyên tử F khác, mỗi nguyên tử nhận 1 electron tạo 7 ion F- có cấu hình [Ne]. Sau đó 8 ion này hút nhau tạo thành chất có công thức (F7+)(F-)7. Vì sao đề xuất này không hợp lí trong thực tế? Hãy mô tả hình thành liên kết trong phân tử F2.
Lời giải:
- Mô hình này không hợp lí trong thực tế. Để tạo ion F7+ cần một năng lượng rất lớn so với tạo F-.
- Mô tả hình thành liên kết trong phân tử F2:
Nguyên tử F có cấu hình electron: 1s22s22p5. Để đạt được cấu hình electron của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy mỗi nguyên tử F cùng góp 1 electron để tạo nên một cặp electron chung cho cả phân tử.
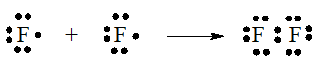
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Cánh Diều hay, chi tiết khác:
Câu hỏi 6 trang 59 Hóa học 10: Những nguyên tử nào trong cation ammonium thỏa mãn quy tắc octet...
Luyện tập 2 trang 59 Hóa học 10: Trình bày sự hình thành ion hydronium (H3O+) từ H2O và H...
Luyện tập 4 trang 61 Hóa học 10: Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và F...
Bài 5* trang 63 Hóa học 10: Khi phản ứng với H2, các phân tử như F2, N2 cần phải phá vỡ liên kết...


