Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại
Lời giải bài 3* trang 56 Hóa học 10 sách Cánh Diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Cánh Diều Bài 10: Liên kết ion
Bài 3* trang 56 Hóa học 10:
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
b) Vì sao cả Na2O và MgO đều là chất rắn ở điều kiện thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Lời giải:
a) Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng, có xu hướng nhường 1, 2, 3 electron này để đạt cấu hình bền vững giống như khí hiếm. Khi nhường electron các ion kim loại mất đi một lớp electron ngoài cùng. Do đó bán kính ion kim loại nhỏ hơn bán kính nguyên tử kim loại tương ứng.
⇒ Xét cụ thể với Na và Mg ta có bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
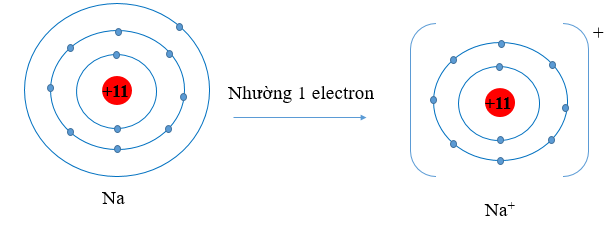
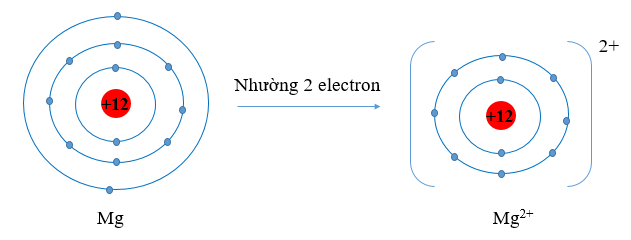
b) Na2O; MgO là các hợp chất ion do đó chúng đều là chất rắn ở nhiệt độ thường.
c) Lực hút tĩnh điện được tính theo công thức sau:
(q1, q2) là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb);
r là khoảng cách giữa hai điện tích điểm; đơn vị là m (meter);
k là hằng số coulomb).
Xét hai phân tử Na2O và MgO ta có:
+ Bán kính ion Na+ > bán kính ion Mg2+
+ Điện tích ion Mg2+ > điện tích ion Na+
⇒ hay liên kết trong MgO bền hơn nhiều so với trong Na2O. Điều này dẫn đến nhiệt độ nóng chảy của MgO cao hơn nhiều so với Na2O.
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Cánh Diều hay, chi tiết khác:


