Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau
Lời giải bài 4 trang 45 Hóa học 10 sách Cánh Diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 10.
Giải Hóa học 10 Cánh Diều Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Bài 4 trang 45 Hóa học 10: Cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 như sau:
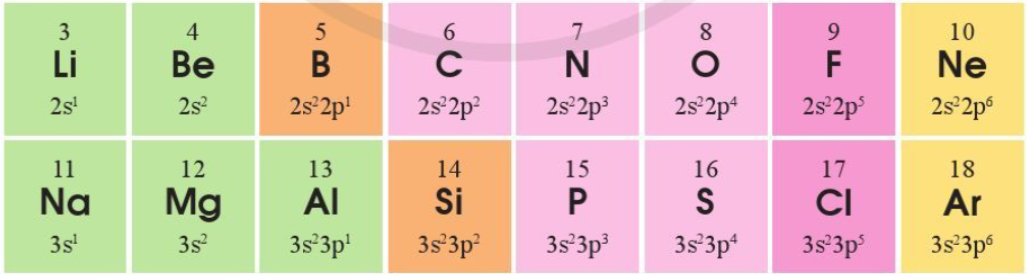
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 thể hiện như thế nào?
b*) Giải thích vì sao sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tính tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3. Lấy một số ví dụ để minh họa sự biến đổi đó.
Lời giải:
a) Sự lặp lại tuần hoàn về cấu hình electron lớp ngoài cùng của các nguyên tố chu kì 2 và 3 thể hiện như sau: Đi từ trái qua phải theo chiều tăng dần điện tích hạt nhân nguyên tử, số electron lớp ngoài cùng tăng dần từ 1 đến 8.
b*) Vì với các nguyên tố chu kỳ 2 và 3 electron hóa trị tham gia vào việc hình thành liên kết hóa học cũng là electron ở lớp ngoài cùng. Do đó, sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng là nguyên nhân quyết định đến sự biến đổi tính tuần hoàn về tính chất hóa học của các đơn chất và hợp chất các nguyên tố chu kì 2 và 3
Một số ví dụ để minh họa sự biến đổi tính chất hóa học của đơn chất và hợp chất:
+ Trong chu kì 2, theo chiều tăng của điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần. Điều này cũng được lặp lại ở các chu kì khác.
+ Trong chu kì 2, theo chiều từ trái sang phải (chiều tăng của điện tích hạt nhân), tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim tăng dần. Điều này cũng được lặp lại ở các chu kì khác.
Xem thêm các bài giải sách giáo khoa Hóa học 10 bộ sách Cánh Diều hay, chi tiết khác:


