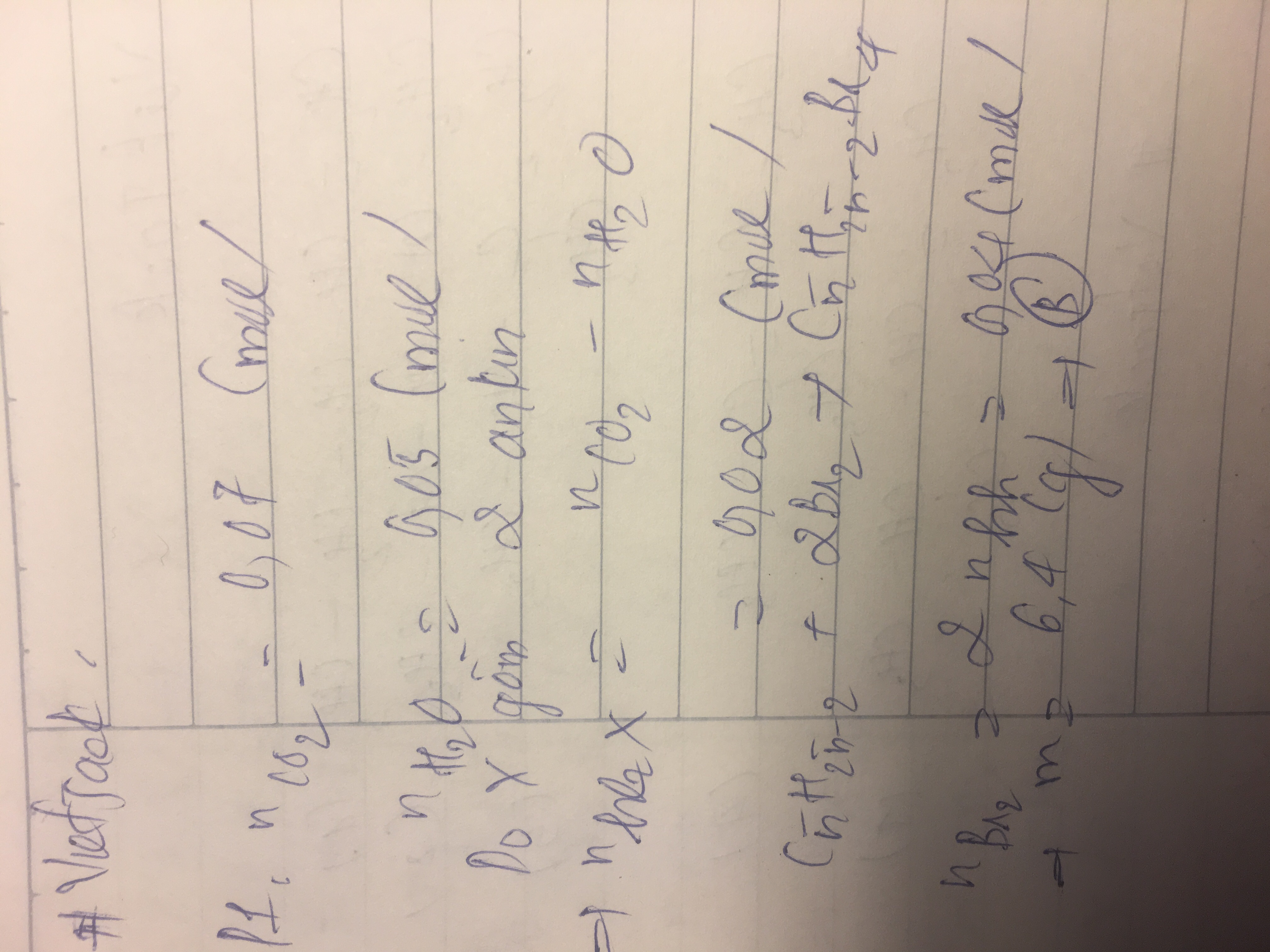chia hỗn hợp ankin C3H4 và C4H6 thành 2 phần đều nhau . phần 1 đem đốt cháy hoàn toàn thu đc 3.08g co2 và 0.9g h2o . phần 2 dẫn qua dd Br2 dư thì lượng Brom phản ứng là bao nhiêu
A.3.8g
B.6.4g
C.3.2g
D.6.8g
Quảng cáo
7 câu trả lời 3232
Để giải quyết bài toán này, ta sẽ phân tích từng phần:
Phần 1: Đốt cháy hoàn toàn hỗn hợp ankin C₃H₄ và C₄H₆
Gọi x là khối lượng của ankin C₃H₄ trong phần 1 và y là khối lượng của ankin C₄H₆ trong phần 1.
Hỗn hợp đốt cháy hoàn toàn sẽ sinh ra CO₂ và H₂O. Phản ứng đốt cháy của ankin là:
CnH2n−2+(n+n−22)O2→nCO2+(n−1)H2O\text{C}_n\text{H}_{2n-2} + (n + \frac{n-2}{2}) \text{O}_2 \to n \text{CO}_2 + (n-1) \text{H}_2\text{O}Với C₃H₄ (propyne):
C3H4+4O2→3CO2+2H2O\text{C}_3\text{H}_4 + 4 \text{O}_2 \to 3 \text{CO}_2 + 2 \text{H}_2\text{O}Với C₄H₆ (butyne):
C4H6+6O2→4CO2+3H2O\text{C}_4\text{H}_6 + 6 \text{O}_2 \to 4 \text{CO}_2 + 3 \text{H}_2\text{O}
Khối lượng CO₂ và H₂O thu được là:
CO₂ có khối lượng mol là 44 g/mol
H₂O có khối lượng mol là 18 g/mol
Ta có:
3.08 g CO2⇒3.0844=0.07 mol CO23.08 \, \text{g CO}_2 \Rightarrow \frac{3.08}{44} = 0.07 \, \text{mol CO}_2 0.07 mol CO2⇒0.07 mol H2O0.07 \, \text{mol CO}_2 \Rightarrow 0.07 \, \text{mol H}_2\text{O} 0.07 mol H2O⇒0.07×18=1.26 g H2O0.07 \, \text{mol H}_2\text{O} \Rightarrow 0.07 \times 18 = 1.26 \, \text{g H}_2\text{O}
Sự chênh lệch khối lượng H₂O là:
0.9−1.26=−0.36g0.9 - 1.26 = -0.36 \text{g}Vậy ta cần điều chỉnh lại phần khối lượng ankin.
\[n_{\text{CO}_2} = \dfrac{m_{\text{CO}_2}}{M_{\text{CO}_2}} = \dfrac{3{,}08\,\text{g}}{44\,\text{g/mol}} \approx 0{,}07\,\text{mol}\]
\[n_{\text{H}_2\text{O}} = \dfrac{m_{\text{H}_2\text{O}}}{M_{\text{H}_2\text{O}}} = \dfrac{0{,}9\,\text{g}}{18\,\text{g/mol}} = 0{,}05\,\text{mol}\]
- Gọi \( a \) là số mol C₃H₄.
- Gọi \( b \) là số mol C₄H₆.
- Số mol C₃H₄: \( \dfrac{a}{2} \).
- Số mol C₄H₆: \( \dfrac{b}{2} \).
\[\text{C}_3\text{H}_4 + 4\text{O}_2 \longrightarrow 3\text{CO}_2 + 2\text{H}_2\text{O} \]
\[\text{C}_4\text{H}_6 + \dfrac{11}{2}\text{O}_2 \longrightarrow 4\text{CO}_2 + 3\text{H}_2\text{O} \]
\[n_{\text{CO}_2} = \dfrac{a}{2} \times 3 + \dfrac{b}{2} \times 4 = \dfrac{3a + 4b}{2} \]
\[n_{\text{H}_2\text{O}} = \dfrac{a}{2} \times 2 + \dfrac{b}{2} \times 3 = \dfrac{2a + 3b}{2} \]
\[\begin{cases}\dfrac{3a + 4b}{2} = 0{,}07 & (1) \\\dfrac{2a + 3b}{2} = 0{,}05 & (2)\end{cases}\]
\[\begin{cases}3a + 4b = 0{,}14 & (1') \\2a + 3b = 0{,}10 & (2')\end{cases}\]
Từ (2') ta có:
\[2a = 0{,}10 - 3b \\\Rightarrow a = \dfrac{0{,}10 - 3b}{2}\]
\[3\left( \dfrac{0{,}10 - 3b}{2} \right) + 4b = 0{,}14 \\\Rightarrow \dfrac{0{,}30 - 9b}{2} + 4b = 0{,}14 \\\Rightarrow 0{,}30 - 9b + 8b = 0{,}28 \\\Rightarrow 0{,}30 - b = 0{,}28 \\\Rightarrow b = 0{,}02\,\text{mol}\]
\[a = \dfrac{0{,}10 - 3 \times 0{,}02}{2} = \dfrac{0{,}04}{2} = 0{,}02\,\text{mol}\]
\[n_{\text{C}_3\text{H}_4} = \dfrac{a}{2} = \dfrac{0{,}02}{2} = 0{,}01\,\text{mol} \]
\[ n_{\text{C}_4\text{H}_6} = \dfrac{b}{2} = \dfrac{0{,}02}{2} = 0{,}01\,\text{mol} \]
\[n_{\text{Br}_2} = 2 \times n_{\text{C}_3\text{H}_4} + 2 \times n_{\text{C}_4\text{H}_6} = 2 \times 0{,}01 + 2 \times 0{,}01 = 0{,}04\,\text{mol}\]
\[m_{\text{Br}_2} = n_{\text{Br}_2} \times M_{\text{Br}_2} = 0{,}04\,\text{mol} \times 160\,\text{g/mol} = 6{,}4\,\text{g}\]
(Vì M(Brom) = 80\,g/mol, nên M(Br₂) = 160\,g/mol)*
`=>`Lượng brom đã phản ứng là 6,4g.
Đáp án: B.
Chúng ta giải bài toán hóa hữu cơ về hỗn hợp ankin từng bước, thuần và dễ hiểu nhé.
Bước 1: Tính số mol C và H từ phần 1 đốt cháy
Cho dữ liệu:
Phần 1 đốt cháy thu được:
(m_{CO_2} = 3.08 , g)
(m_{H_2O} = 0.9 , g)
Số mol C:
[
n_C = \frac{m_{CO_2}}{M_{CO_2}} = \frac{3.08}{44} \approx 0.07 , mol
]
Số mol H:
[
n_H = 2 \cdot n_{H_2O} = 2 \cdot \frac{0.9}{18} = 2 \cdot 0.05 = 0.1 , mol
]
Bước 2: Gọi số mol các ankin trong phần 1
Công thức:
C3H4 → ankin 3C, 4H
C4H6 → ankin 4C, 6H
Gọi:
(x = n_{C3H4})
(y = n_{C4H6})
Hệ phương trình từ C và H:
Từ C: (3x + 4y = 0.07\cdot? )
Lưu ý: số mol C: 0.07 mol tổng cộng
Từ số mol C:
[
3x + 4y = 0.07
]
Từ H: (4x + 6y = 0.1)
Bước 3: Giải hệ phương trình
Hệ:
[
\begin{cases}
3x + 4y = 0.07 \
4x + 6y = 0.1
\end{cases}
]
Nhân phương trình 1 với 2, phương trình 2 với 3:
[
6x + 8y = 0.14
12x + 18y = 0.3
]
Trừ: ( (12x+18y) - 2*(6x+8y) = 12x+18y - 12x -16y = 2y = 0.3 -0.28=0.02)
[
y = 0.01 , mol
]
Thay vào 3x+4y=0.07 → 3x + 0.04 = 0.07 → 3x=0.03 → x=0.01 mol
Bước 4: Tính lượng Br2 phản ứng
Phản ứng thế với Br2:
C3H4: có 1 liên kết ba → phản ứng với 1 mol Br2 / mol ankin?
Trong ankin, mỗi liên kết ba phản ứng với 2 mol Br2 (cộng Br vào liên kết ba → thành anken dibrom)
C3H4 → 1 liên kết ba → 1 mol C3H4 phản ứng với 2 mol Br2
C4H6: cũng có 1 liên kết ba → 1 mol C4H6 phản ứng với 2 mol Br2
Số mol Br2:
[
n_{Br2} = 2x + 2y = 20.01 + 20.01 = 0.04 , mol
]
Khối lượng Br2: (m = n \cdot M = 0.04 \cdot 160 = 6.4 , g)
✅ Kết quả:
Lượng Br phản ứng = 6.4 g → Chọn B
Nếu bạn muốn, mình có thể vẽ sơ đồ phản ứng Br2 với ankin để dễ hình dung. Bạn có muốn mình vẽ không?
Quảng cáo
Bạn cần hỏi gì?
Câu hỏi hot cùng chủ đề
-
 Đã trả lời bởi chuyên gia
101718
Đã trả lời bởi chuyên gia
101718 -
 Đã trả lời bởi chuyên gia
89691
Đã trả lời bởi chuyên gia
89691 -
 Đã trả lời bởi chuyên gia
68738
Đã trả lời bởi chuyên gia
68738 -
Hỏi từ APP VIETJACK64805
-
 Đã trả lời bởi chuyên gia
63876
Đã trả lời bởi chuyên gia
63876 -
 Đã trả lời bởi chuyên gia
55343
Đã trả lời bởi chuyên gia
55343 -
Hỏi từ APP VIETJACK44914
-
Hỏi từ APP VIETJACK
 Đã trả lời bởi chuyên gia
43294
Đã trả lời bởi chuyên gia
43294