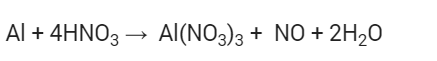Cho phương trình phản ứng: a Al + b HNO3 → c Al(NO3)3 + d NO + e H2O . Tỉ lệ a:b là:
A. 2:3
B. 2:5
C. 1:3
D. 1:4
Quảng cáo
6 câu trả lời 68738
Cho phương trình phản ứng: a Al + b HNO3 → c Al(NO3)3 + d NO + e H2O . Tỉ lệ a:b là:
A. 2:3
B. 2:5
C. 1:3
D. 1:4
A. 2:3
B. 2:5
C. 1:3
D. 1:4
Để tìm tỉ lệ a:b, chúng ta cần cân bằng phương trình phản ứng oxi hóa - khử này bằng phương pháp thăng bằng electron.
1. Xác định sự thay đổi số oxi hóa-
Al0→Al+3+3e (Quá trình oxi hóa)
-
N+5+3e→N+2 (trong NO) (Quá trình khử)
Vì cả hai quá trình đều trao đổi 3e, ta có tỉ lệ số mol giữa Al và NO là 1:1.
-
1×(Al0→Al+3+3e)
-
1×(N+5+3e→N+2)
-
Hệ số của Al (a) = 1
-
Hệ số của Al(NO3)3 (c) = 1
-
Hệ số của NO (d) = 1
Để tìm hệ số của HNO3 (b), ta bảo toàn nguyên tố Nitơ (N):
Cuối cùng, bảo toàn Hydro để tìm e: 4 H→2 H2O (vậy e=2).
Phương trình hoàn chỉnh:
Tỉ lệ a:b tương ứng với 1:4.
=> Đáp án đúng là: D.
Quảng cáo
Bạn cần hỏi gì?
Câu hỏi hot cùng chủ đề
-
 Đã trả lời bởi chuyên gia
9563
Đã trả lời bởi chuyên gia
9563 -
 Đã trả lời bởi chuyên gia
7747
Đã trả lời bởi chuyên gia
7747 -
 Đã trả lời bởi chuyên gia
7155
Đã trả lời bởi chuyên gia
7155 -
 Đã trả lời bởi chuyên gia
6604
Đã trả lời bởi chuyên gia
6604