Quảng cáo
2 câu trả lời 496
a) Phương trình hóa học cho phản ứng giữa axit axetic (CH3COOH) và natri cacbonat (Na2CO3) là:
\[ \text{CH3COOH} + \text{Na2CO3} \rightarrow \text{CH3COONa} + \text{CO2} + \text{H2O}\]
b) Theo phương trình trên, 1 mol CH3COOH phản ứng với 1 mol Na2CO3 sẽ sinh ra 1 mol CO2. Vì vậy, để tính lượng CO2 sinh ra, ta cần biết số mol CH3COOH có trong dung dịch.
Trước tiên, ta cần tính số mol CH3COOH trong 200g dung dịch CH3COOH 12%.
Trọng lượng mol của CH3COOH là 60 g/mol (C = 12, H = 1, O = 16), do đó:
Số mol CH3COOH = \(\frac{{\text{khối lượng CH3COOH trong dung dịch}}}{{\text{trọng lượng mol của CH3COOH}}} = \frac{{12\% \times 200\text{g}}}{{60\text{g/mol}}} = 0.4\text{mol}\)
Vậy, số mol CO2 sinh ra cũng là 0.4 mol.
Theo điều kiện chuẩn, 1 mol CO2 chiếm thể tích 22.4 L. Vậy, thể tích CO2 sinh ra là:
\(V_{CO2} = 0.4 \text{mol} \times 22.4 \text{L/mol} = 8.96 \text{L}\)
c) Để tính lượng muối (CH3COONa) thu được, ta cần biết số mol Na2CO3 phản ứng và mối quan hệ giữa số mol Na2CO3 và CH3COONa.
Số mol Na2CO3 = \(\frac{{\text{khối lượng Na2CO3 trong dung dịch}}}{{\text{trọng lượng mol của Na2CO3}}} = \frac{{10.6\% \times 200\text{g}}}{{105.99\text{g/mol}}} = 0.2\text{mol}\)
Do phản ứng 1 mol Na2CO3 tạo ra 1 mol CH3COONa, nên số mol CH3COONa thu được cũng là 0.2 mol.
Khối lượng muối thu được:
\(m_{muối} = \text{số mol CH3COONa} \times \text{trọng lượng mol của CH3COONa} = 0.2\text{mol} \times 82.03\text{g/mol} = 16.406\text{g}\)
d) Để tính nồng độ phần trăm của dung dịch muối sau phản ứng, ta sẽ tính tổng khối lượng của dung dịch sau phản ứng, sau đó tính phần trăm của muối trong dung dịch đó.
Tổng khối lượng của dung dịch sau phản ứng bao gồm khối lượng muối và nước:
\(m_{tổng} = m_{muối} + m_{nước} = 16.406\text{g} + 200\text{g} = 216.406\text{g}\)
Nồng độ phần trăm của dung dịch muối sau phản ứng:
\[\text{Nồng độ phần trăm muối} = \frac{{m_{muối}}}{{m_{tổng}}} \times 100\% = \frac{{16.406\text{g}}}{{216.406\text{g}}} \times 100\% \approx 7.59\%\]
Quảng cáo
Bạn muốn hỏi bài tập?
Câu hỏi hot cùng chủ đề
-
45267
-
Hỏi từ APP VIETJACK31387

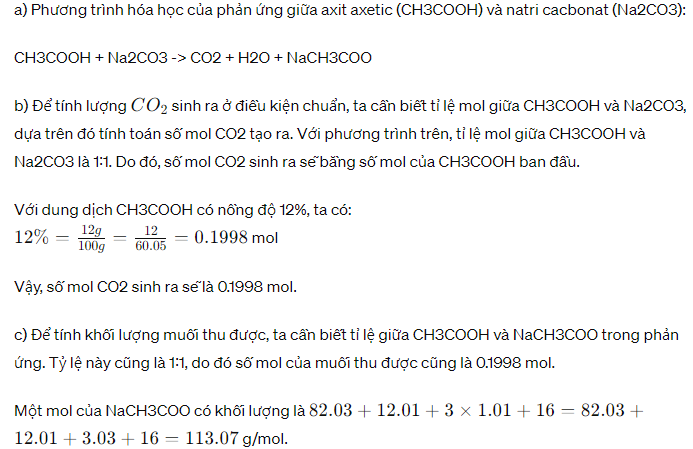
 anh gửi
anh gửi
