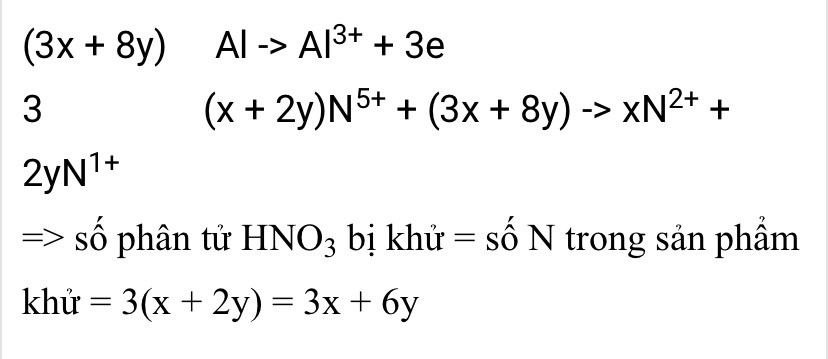Quảng cáo
4 câu trả lời 366
1 năm trước
Để giải bài toán này, ta cần cân bằng phương trình hoá học trước.
Phương trình hoá học ban đầu:
Al + HNO3 -> Al(NO3)3 + NO + N2O + H2O
Ta cần cân bằng số nguyên tối giản các hệ số của các chất trong phản ứng.
Để làm điều này, ta cần xác định tỉ lệ số mol giữa NO và N2O.
Theo phản ứng, ta có:
1 mol Al tác dụng với 3 mol HNO3
tạo ra 1 mol Al(NO3)3 1 mol Al
tạo ra 1 mol NO 1 mol Al
tạo ra 1 mol N2O
Vậy tỉ lệ số mol giữa NO và N2O là 1:1.
Sau khi cân bằng phương trình hoá học, ta có phương trình cân bằng như sau:
8Al + 24HNO3 -> 8Al(NO3)3 + 3NO + 3N2O + 12H2O
Hệ số của HNO3 trong phản ứng cân bằng là 24.
Vậy, hệ số của HNO3 là 24 sau khi cân bằng phản ứng hoá học.
1 năm trước
Để cân bằng phản ứng hoá học này, trước hết, chúng ta cần viết phương trình phản ứng cân bằng:
\[2Al + 6HNO_3 \rightarrow 2Al(NO_3)_3 + 3NO + N_2O + 3H_2O\]
Sau đó, ta có thể thấy rằng tỉ lệ số mol giữa \(NO\) và \(N_2O\) là \(3:1\). Điều này tương đương với tỉ lệ số mol \(NO\) và \(N_2O\) là \(3x : x\), với \(x\) là hệ số của \(N_2O\).
Tổng số mol nitơ trước phản ứng là \(3x + x = 4x\). Tổng số mol nitơ sau phản ứng là \(3 + 1 = 4\). Vậy ta có phương trình:
\[4x = 4\]
\[x = 1\]
Vậy hệ số của \(N_2O\) là 1. Do đó, hệ số của \(HNO_3\) sẽ là \(\frac{6}{2} = 3\).
Quảng cáo
Bạn muốn hỏi bài tập?
Câu hỏi hot cùng chủ đề
-
25717
Gửi báo cáo thành công!