Câu 99: Xét phản ứng thuận nghịch : SO2(g) +NO2(g) = SO3(g) +NO(g) . Cho 0,11 mol SO2; 0,1 mol NO2 và 0,07 mol SO3 vào bình kín dung tích không đổi 1 L. Khi đạt cân bằng hóa học thì NO2
còn lại là 0,02 mol. Tính hằng số cân bằng của phản ứng trên?
Quảng cáo
2 câu trả lời 21566
Phản ứng hóa học:
![]()
Dữ kiện:
Ban đầu:
![]()
Khi cân bằng:
![]()
Thể tích bình: V = 1 L.
Bước 1: Biểu diễn số mol các chất tại cân bằng
Giả sử số mol SO2 và NO2 phản ứng là x:

Dựa vào dữ kiện cân bằng:
Suy ra:
0,1 - x = 0,02 x = 0,08.
Bước 2: Tính số mol cân bằng của các chất
Thay x = 0,08:
Bước 3: Hằng số cân bằng Kc
Công thức:
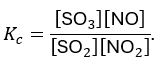
Vì V = 1 L, nồng độ cân bằng bằng số mol:
Thay vào:
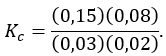
Tính toán:
![]()
Kết luận
Hằng số cân bằng:
Kc = 20.
Đầu tiên, ta cần viết phương trình cân bằng:
\[ SO_2(g) + NO_2(g) \rightleftharpoons SO_3(g) + NO(g) \]
Lập bảng thay đổi nồng độ khi phản ứng xảy ra:
\[
\begin{array}{l|ccc|c}
& SO_2 & NO_2 & SO_3 & NO \\
\hline
\text{Ban đầu} & 0.11 & 0.1 & 0.07 & 0 \\
\text{Thay đổi} & -x & -x & +x & +x \\
\text{Khi cân bằng} & 0.11 - x & 0.1 - x & 0.07 + x & x \\
\end{array}
\]
Theo đề bài, ta biết \([NO_2]\) khi cân bằng là 0.02 mol/L. Vì vậy, \(0.1 - x = 0.02 \Rightarrow x = 0.08\).
Lúc này, các nồng độ khi cân bằng là:
\[ [SO_2] = 0.11 - 0.08 = 0.03 \text{ mol/L} \]
\[ [NO_2] = 0.02 \text{ mol/L} \]
\[ [SO_3] = 0.07 + 0.08 = 0.15 \text{ mol/L} \]
\[ [NO] = 0.08 \text{ mol/L} \]
Hằng số cân bằng \(K_c\) cho phản ứng này được định nghĩa là:
\[ K_c = \frac{[SO_3] \times [NO]}{[SO_2] \times [NO_2]} \]
Thay các giá trị nồng độ khi cân bằng vào:
\[ K_c = \frac{0.15 \times 0.08}{0.03 \times 0.02} = \frac{0.012}{0.0006} = 20 \]
Vậy, \(K_c = 20\).
Quảng cáo
Bạn muốn hỏi bài tập?
Câu hỏi hot cùng chủ đề
-
Hỏi từ APP VIETJACK64705
-
Hỏi từ APP VIETJACK44807


