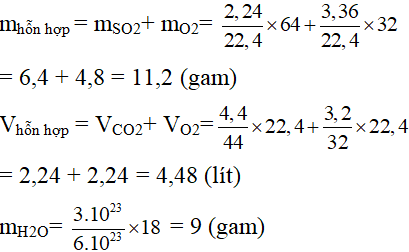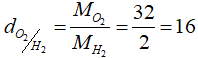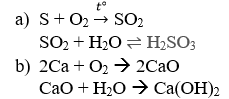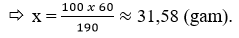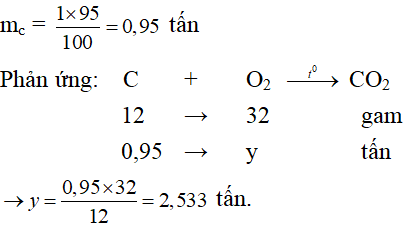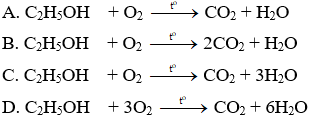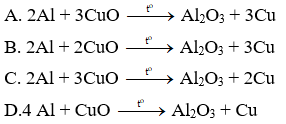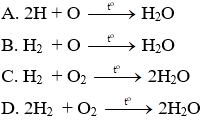Bộ 30 đề thi Học kì 1 Hóa học lớp 8 có đáp án
Bộ 30 đề thi Học kì 1 Hóa học lớp 8 có đáp án giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 8 Học kì 1. Mời các bạn cùng đón xem:
[Năm 2023] Đề thi Học kì 1 Hóa học lớp 8 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 1)Phần trắc nghiệm
Câu 1. Trong các dãy chất sau dãy nào toàn là đơn chất?
A. H2, O2, Na, Al
B. CaO, CO2, ZnO, O2
C. H2NO3, H2CO3, H2SO4.
D. Na2SO4, K2SO4, CaCO3.
Câu 2. Trong các dãy chất sau dãy nào toàn là hợp chất?
A. C, H2, Cl2, CO2.
B. H2, O2, Al , Zn;
C. CO2, CaO, H2O;
D. Br2, HNO3, NH3.
Câu 3. Biết Al có hóa trị (III) và O có hóa trị (II) nhôm oxit có công thức hóa học là:
A. Al2O3
B. Al3O2
C. AlO3
D. Al2O
Câu 4. Quá trình nào sau đây là xảy hiện tượng hóa học:
A. Muối ăn hòa vào nước.
B. Đường cháy thành than và nước
C. Cồn bay hơi
D. Nước dạng rắn sang lỏng
Câu 5. Phân tử khối của hợp chất CaCO3 là:
A. 70 g/mol
B. 80 g/mol
C. 90 g/mol
D.100 g/mol
Câu 6. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nhôm nung nóng chảy để đúc xoong, nồi…
B. Than cần đập vừa nhỏ trước khi đưa vào bếp lò.
C. Cồn để trong lọ không kín bị bay hơi.
D. Trứng để lâu ngày sẽ bị thối.
Câu 7. Trong công thức hóa học của hiđrô sunfua (H2S) và khí sunfurơ (SO2), hóa trị của lưu huỳnh lần lượt là:
A. I và II
B. II và IV
C. II và VI
D. IV và VI
Câu 8 : Trong quá trình phản ứng, lượng chất phản ứng :
A. Giữ nguyên
B. Tăng
C. Giảm dần
D. Cả a,b,c
Phần tự luận
Câu 1 (1,5đ): Trong các công thức hoá hoá học sau, công thức nào đúng? Công thức nào sai? Hãy sửa lại công thức sai.
a. NaO
b. CaCl2
c. Al3O2
Câu 2 (2đ): Lập phương trình hoá học và cho biết tỉ lệ số nguyên tử, số phân tử các chất trong phản ứng.
a) Al(OH)3 → Al2O3 + H2O (nhiệt độ)
b) Fe + HCl → FeCl2 + H2
Câu 3 (2,5đ): Hòa tan hoàn toàn 56g sắt bằng dung dịch axit clohiđric( HCl ), phản ứng kết thúc thu được muối sắt clorua ( FeCl2) và khí hiđro.
a. Lập phương trình hóa học.
b. Tính khối lượng axit clohiđric(HCl) đã tham gia phản ứng.
c. Tính thể tích khí hiđro sinh ra ( ở đktc)
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 1
A. Phần trắc nghiệm (4đ)
Đúng mỗi câu được (0.5 điểm)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | A | C | A | B | D | D | B | C |
B. Tự luận (6đ)
Câu 1: (1,5đ) Mỗi đáp án đúng 0,5 điểm
CTHH đúng: b. CaCl2
CTHH sai: a. NaO ⇒ sửa: Na2O
CTHH sai: c. Al3O2 ⇒ sửa : Al2O3
Câu 2: (2đ)
a. 2 Al(OH)3 → Al2O3 + 3H2O (1 điểm)
Tỉ lệ: nAl(OH)3 : nAl2O3 : nH2O = 2 : 1 : 3
b. Fe + 2HCl → FeCl2 + H2 (1 điểm)
Tỉ lệ: nFe : nHCl : nFeCl2 : nH2 = 1 : 2 : 1 : 1
Câu 3: (2,5đ)
- Số mol của 56g sắt là:
nFe = m: M = 56 : 56 = 1 (mol) (0.5 điểm)
a. Fe + 2HCl → FeCl2 + H2 (0.5 điểm)
Theo pt: 1mol 2mol 1mol
Theo bài ra: 1mol 2mol 1mol (0.5 điểm)
b. Theo pt nHCl = 2.nFe = 2.1 = 2 mol
Khối lượng axit clohiđric (HCl) đã tham gia phản ứng: (0.5 điểm)
mHCl = nHCl . MHCl = 2 . 36,5 = 73 (g)
c. Theo pt nH2 = nFe = 1 mol
Thể tích của hiđro sinh ra là:
VH = nH2. 22,4 = 1 . 22,4 = 22,4 (l) (0.5 điểm)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 2)Phần trắc nghiệm
Câu 1: Số e trong nguyên tử Al (có số proton = 13), là:
A. 10
B. 11
C. 12
D. 13
Câu 2: Số e lớp ngoài cùng của nguyên tử Al (có số proton = 13) là:
A. 1
B. 2
C. 3
D. 4
Câu 3: Số lớp e của nguyên tử Al (có số proton = 13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 4: Khối lượng của 1 nguyên tử Cacbon là:
A. 1,9926.10-23g
B. 1,9926g
C. 1,9926.10-23 đvC
D. 1,9926 đvC
Câu 5: Khối lượng của 1 đvC là:
A. 1,6605.10-23 g
B. 1,6605.10-24 g
C. 6.1023 g
D. 1,9926.10-23 g
Câu 6: Hiện tượng hoá học khác với hiện tượng vật lý là :
A. Chỉ biến đổi về trạng thái.
B. Có sinh ra chất mới.
C. Biến đổi về hình dạng.
D. Khối lượng thay đổi.
Câu 7 : Cho biết công thức hóa học hợp chất của nguyên tố X với O là: XO và hợp chất của nguyên tố Y với H là: YH3 (X; Y là những nguyên tố nào đó). Công thức hóa học đúng cho hợp chất X với Y là:
A. X3Y2
B.X2Y3
C.XY3
D.XY
Câu 8 : Trong 1 phản ứng hoá học các chất phản ứng và sản phẩm chứa cùng:
A. Số nguyên tử của mỗi nguyên tố.
B. Số phân tử trong mỗi chất.
C. Số phân tử của mỗi chất.
D.Số nguyên tố tạo ra chất.
Câu 9: Tỉ lệ % khối lượng của các nguyên tố Ca, C, O trong CaCO3 lần lượt là:
A. 40% , 40% , 20%
B. 20% , 40% , 40%
C. 40% , 12% , 48%
D. 10% , 80% , 10%
Câu 10: Trong hợp chất AxBy . Hoá trị của A là m, hoá trị của B là n thì quy tắc hóa trị là:
A. m.n = x.y
B. m.y = n.x
C. m.A= n.B
D. m.x = n.y
Phần tự luận
Câu 1 (2đ): Phát biểu nội dung định luật bảo toàn khối lượng.
Áp dụng : Nung 10,2g đá vôi ( CaCO3 ) sinh ra 9g vôi sống và khí cacbonic
a. Viết công thức về khối lượng.
b. Tính khối lượng khí cacbonic sinh ra.
Câu 2 (2đ): Lập phương trình hóa học của các phản ứng sau:
a. Nhôm + Khí ôxi → Nhôm ôxit.
b. Natri + Nước → Natri hiđrôxit + Khí Hiđrô
Câu 3 (3đ): Cho 13 gam Kẽm tác dụng vừa đủ với axit clohiđric theo phương trình
Zn + HCl → ZnCl2 + H2
a. Tính số mol Zn và lập phương trình phản ứng trên.
b. Tính thể tích khí H2 thoát ra (đktc).
c. Tính khối lượng axit clohiđric (HCl) đã dùng cho phản ứng trên.
(Cho KLNT: Ca = 40; C = 12; O = 16; Zn = 65; H = 1; Cl = 35,5)
(Hóa trị: Al(III); O(II); Na(I); H(I))
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 2
A . TRẮC NGHIỆM KHÁCH QUAN (3 Điểm)
Chọn và khoanh tròn vào chữ cái có phương án trả lời đúng nhất. Mỗi câu trả lời đúng 0.3đ
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | C | C | A | B | B | A | D | C | D |
B. PHẦN TỰ LUẬN : (7 Điểm)
Câu 1: (2đ) Phát biểu đúng nội dung định luật bảo toàn khối lượng được (1đ).
Áp dụng :
a. mCaCO3 = mCaO + mCO2 (0.5 điểm)
b. mCO2 = mCaCO3 – mCaO = 10,2 – 9 = 1,2 g (0.5 điểm)
Câu 2: (2đ)
- Mỗi PTHH viết đúng được (0.5 điểm)
- Mỗi PTHH cân bằng đúng được (0.5 điểm)
a. 4Al + 3O2 → 2Al2O3
b. 2Na + 2H2O → 2NaOH + H2
Câu 3: (3đ):
a. Số mol Zn: nZn = m/M = 0,2 mol (0.5 điểm)
Lập phương trình phản ứng trên.
Zn + 2HCl → ZnCl2 + H2 (0.5 điểm)
1mol 2mol 1mol 1mol
0,2 mol 0,4 mol 0,2 mol 0,2 mol
b. nH2 = nZn = 0,2 mol (0.5 điểm)
Thể tích khí H2 thoát ra (đktc). V = n.22,4 = 0,2.22,4 = 4,48 lít (0.5 điểm)
c. Khối lượng axit clohiđric (HCl) đã dùng cho phản ứng trên.
nH2 = 2nZn = 0,4 mol (0.5 điểm)
mHCl = n.M = 0,4.36,5 = 14,6 g (0.5 điểm)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 3)Câu 1: ( 1 diểm) Đơn chất là gì? Viết công thức hoá học của 2 đơn chất
Câu 2: ( 1 điểm) Hiện tượng hoá học là gì? Cho ví dụ?
Câu 3: ( 3 điểm) Lập PTHH của các phản ứng sau:
a. Mg + O2 → MgO
b. Fe + Cl2 → FeCl3
c. NaOH + CuCl2 → Cu(OH)2 + NaCl
d. HCl + Mg → MgCl2 + ?
e. Fe2O3 + HCl → FeCl3 + H2O
f. Al + O2 → Al2O3
Câu 4: ( 2 điểm) Một chất khí A có tỉ khối đối với H2 là 8, có thành phần các nguyên tố gồm: 75% C và 25% H. Hãy lập công thức hoá học của hợp chất A
(Biết C = 12 , H = 1)
Câu 5: (3 điểm) Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng : Zn + HCl → ZnCl2 + H2
a. Lập PTHH của phản ứng.
b. Tính khối lượng HCl đã tham gia phản ứng
c. Tính thể tích khí H2 (ĐKTC) đã sinh ra sau phản ứng
( Biết Zn = 65 , H = 1 , Cl = 35,5 )
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 3
Câu 1:
- Đơn chất là những chất được tạo nên từ một nguyên tố hoá học. (0.5 điểm)
- Ví dụ: Al , N2 (mỗi ví dụ đúng 0,25 đ) (0.5 điểm)
Câu 2:
- Hiện tượng chất biến đổi có tạo ra chất mới gọi là hiện tượng hoá học (0.5 điểm)
- Ví dụ: đường cháy thành than và nước (0.5 điểm)
Câu 3:
Lập đúng các PTHH mỗi PT (0,5 điểm)
a. 2Mg + O2 → 2MgO
b. 2Fe + 3Cl2 → 2FeCl3
c. 2NaOH + CuCl2 → Cu(OH)2 + 2NaCl
d. 2HCl + Mg → MgCl2 + H2
e. Fe2O3 + 6 HCl → 2FeCl3 + 3 H2O
f. 4Al + 3O2 → 2 Al2O3
Câu 4:
Ta có: MA = 8 . 2 = 16 (g) (0,5 điểm)
mC = 16. 75% = 12 (g) (0,25 điểm)
nC = 12 /12 = 1 (mol) (0,25 điểm)
mH = 16 – 12 = 4 (g) (0,25 điểm)
nH = 4 / 1 = 4 (mol) (0,25 điểm)
Công thức hoá học: CH4 (0,5 điểm)
Câu 5:
a. PTHH: Zn + 2HCl → ZnCl2 + H2 (0,5 điểm)
nZn = 13 : 65 = 0,2 (mol) (0,5 điểm)
b.Theo PT: nHCl = 2 nZn = 2. 0,2 = 0,4 mol (0,5 điểm)
Vậy mHCl = 0,4 . 36,5 = 14,6(g) (0,5 điểm)
c. Theo PTHH: nH2 = nZn = 0,2 mol (0,5 điểm)
VH2 (đktc) = 0,2 . 22,4 = 4,48 (l) (0,5 điểm)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 4)Phần trắc nghiệm
Câu 1. Hạt nhân nguyên tử cấu tạo bởi:
A. Proton và electron
B. Proton và nơtron
C. Nơtron và electron
D. Proton, nơtron và electron.
Câu 2. Dãy chất gồm các đơn chất:
A. Na, Ca, CuCl2, Br2.
B. Na, Ca, CO, Cl2
C. Cl2, O2, Br2, N2.
Câu 3. Công thức hoá học của hợp chất tạo bởi nguyên tố R với nhóm SO4 là R2(SO4)3. Công thức hoá học của hợp chất tạo bởi nguyên tố R và nguyên tố O là:
A. RO
B. R2O3
C. RO2
D. RO3
Câu 4. Chất khí A có dA/H2 = 14 công thức hoá học của A là:
A. SO2
B. CO2
C. NH3
D. N2
Câu 5. Số phân tử của 16 gam khí oxi là:
A. 3. 1023
B. 6. 1023
C. 9. 1023
D. 12.1023
Câu 6. Đôt cháy hết một phân tử hợp chất A( chưa biết) cần 2 phân tử O2 . Sau phản ứng thu được 2 phân tử CO2 và 2 phân tử H2O. Công thức hoá học của hợp chất A là:
A. C2H6
B. C2H4
C. C2H4O
D. C2H4O2
Phần tự luận
Câu 1. (3 điểm): Hoàn thành các phương trình hoá học sau:
1. Na + O2 → Na2O
2. Na3PO4 + BaCl2 → NaCl + Ba3(PO4)2
3. Al2O3 + H2SO4 → Al2(SO4)3 + H2O
( Cân bằng luôn vào các phản ứng phía trên, không cần viết lại)
Câu 2. (3 điểm): Cho a gam nhôm (Al) tác dụng vừa đủ với dung dịch chứa 29,4 gam axit sunfuric ( H2SO4 ). Sau phản ứng thu được muối nhôm sunfat ( Al2(SO4)3 ) và khí hiđro ( H2)
a. Viết phương trình hóa học?
b. Tính a gam nhôm đã tham gia phản ứng?
c. Tính thể tích khí hiđro sinh ra ( ở đktc)?
Câu 3 (1 điểm): Hợp chất A chứa nguyên tố: Fe và O . Trong phân tử A có 7 nguyên tử và MA = 232 (g/mol). Tìm công thức hoá học của A?
(Cho biết : S = 32 ; O = 16; Al = 27; H = 1; Fe = 56; C = 12)
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 4
I. TRẮC NGHIỆM (3 điểm):
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đáp án | B | C | B | D | A | D |
II. PHẦN TỰ LUẬN (7 điểm):
Câu 1 (3đ): Mỗi phản ứng cân bằng đúng 1đ
1. 4Na + O2 → 2Na2O
2. 2Na3PO4 + 3BaCl2 → 6NaCl + Ba3(PO4)2
3. Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Câu 2 (3đ):
a. ( 0,5đ) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
b. (1,25đ) Tính được khối lượng a gam nhôm: 5,4( gam)
nH2SO4 = 29,4 / 98 = 0,3 mol
Theo pt: nAl = 2/3 . nH2SO4 = 0,3 . 2/3 = 0,2 mol
mAl = 27 . 0,2 = 5,4 g
c. (1,25đ) Tính được thể tích khí H2 sinh ra (đktc): 6,72 ( lít)
Theo pt: nH2 = nH2SO4 = 0,3 mol
⇒ VH2 = 0,3 . 22,4 = 6,72 l
Câu 3 (1đ) Xác định được công thức hoá học của hợp chất A: Fe3O4
Đặt CTHH là FexOy
Theo bài ta có: 56x + 16 y = 232
x + y = 7
Giải hệ ⇒ x = 3, y = 4 ⇒ Fe3O4
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 5)I. TRẮC NGHIỆM
Hãy khhoanh tròn một trong các chữ A, B, C, D trước phương án chọn đúng.
Câu 1: Hãy chọn câu phát biểu đúng.
A. Nguên tử là những hạt vô cùng nhỏ gồm proton mang điện tích dương và các electron mang điện tích âm.
B. Nguyên tử là những hạt vô cùng nhỏ, trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử tạo bởi các electron mang điện tích âm.
C. Hạt nhân nguyên tử gồm các hạt proton, nowtron, electron.
D. Trong mỗi nguyên tử số proton bằng số electron cộng với số nowtron.
Câu 2: Cho các chất có công thức hóa học như sau:
1. O2
2. O3
3. CO2
4. Fe2O3
5. SO2
6. N2
7. H2O
Nhóm chỉ gồm các hợp chất là:
A. 1, 3, 5, 7
B. 2, 4, 6, 5
C. 2, 3, 5, 6
D. 3, 4, 5, 7
Câu 3: Một bình chứa hỗn hợp khí X gồm 1,12 lít khí oxi và 2,24 lít khí cacbon đioxit ở đktc. Tổng số mol các khí trong hỗn hợp khí X là:
A. 0,25
B. 0,5
C. 0,15
D. 0,20
Câu 4: Công thức hóa học hợp chất của nguyên tố X với nhóm SO4 có hóa trị II là X2(SO4)3. Công thức hóa học hợp chất của nguyên tố Y với hidro là H3Y.
Công thức hóa học hợp chất của nguyên tố X và nguyên tố Y là:
A. XY2
B. XY3
C. XY
D. X2Y3
Câu 5: Đốt cháy hoàn toàn 12,8 gam đồng (Cu) trong bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (CuO). Khối lượng oxi đã tham gia phản ứng là:
A. 6,4 gam
B. 4,8 gam
C. 3,2 gam
D. 1,67 gam
Câu 6: Khối lượng của 0,5 mol Mg và 0,3 mol CO2 tương ứng là:
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(Cho Mg = 24; O = 16; C = 12).
Câu 7: Hãy điền các hệ số vào trước các công thức hóa học của các chất thích hợp để được các phương trình hóa học đúng.
___Al + ___H2SO4 → Al2(SO4)3 + ___H2
A. 2, 3, 1, 3
B. 3, 2, 1, 3
C. 2, 2, 1, 3
D. 2, 3, 3, 1
Câu 8: Thể tích hỗn hợp khí gồm 0,5 mol CO2 và 0,2 mol O2 ở điều kiện tiêu chuẩn là:
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
II. TỰ LUẬN
Câu 9:
1) Tính khối lượng của hỗn hợp khí ở đktc gồm 2,24 lít SO2 và 3,36 lít O2.
2) Tính thể tích ở đktc của một hỗn hợp khí gồm 4,4 gam CO2 và 3,2 gam O2.
3) Tính số mol chứa trong 3.1023 phân tử nước.
Câu 10: Phản ứng hóa học xảy ra khi cồn cháy (đèn cồn trong phòng thí nghiệm) là
Rượu etylic (C2H5OH) + oxi cacbonic (CO2) + nước
1) Hãy lập phương trình hóa học của phản ứng.
2) Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.
3) Tính tỉ lệ về khối lượng giữa các chất trong phản ứng hóa học.
4) Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic và thể tích khí cacbonic tạo thành ở điều kiện tiêu chuẩn.
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 5
I. TRẮC NGHIỆM
Câu 1: chọn B
Câu 2: chọn D
Câu 3: chọn C
Hướng dẫn: nO2= 1,12/22,4 = 0,05 (mol)
nCO2= 2,24/22,4 = 0,1 (mol)
nhhX = nO2+ nCO2= 0,05 + 0,1 = 0,15 (mol)
Câu 4: chọn C
Hướng dẫn: * X2(SO4)3 : a x 2 = II x 3 → a = III
* H3Y : I x 3 = b x 1 → b = III → CTHH: XY
Câu 5: chọn C
Hướng dẫn: Áp dụng ĐLBTKL, ta có:
mCu+ mO2= mCuO→ mO2= mCuO- mCu= 16 – 12,8 = 3,2 (gam)
Câu 6: chọn C
Hướng dẫn: +) mMg = 0,5.24 = 12 (gam)
+) mCO2= 0,3.44 = 13,2 (gam)
Câu 7: Hướng dẫn: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑. Chọn A
Câu 8: chọn D
Hướng dẫn: Vhh = (0,5+0,2) x 22,4 = 15,68 (lít)
II. TỰ LUẬN
Câu 9:
Câu 10:
C2H5OH + 3O2 −to→ 2CO2 + 3H2O (1)
Tỉ lệ số phân tử C2H5OH: số phân tử O2: số phân tử CO2: số phân tử H2O = 1 : 3 : 2 : 3
mC2H5OH ∶ mO2 ∶ mCO: mH2O = 46 : (3x32) : (2x44) : (3x18)
= 46 : 96 : 88 : 54
Ta có : nC2H5OH= 4,6/46 = 0,1 (mol)
Từ (1) → nCO2=0,2 (mol) → VCO2= 0,2.22,4 = 4,48 (lít)
Từ (1) → nO2= 0,3 (mol) → VO2= 0,3.22,3 = 6,72 (lít)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 6)I. TRẮC NGHIỆM
Học sinh hãy chọn và khoanh tròn câu trả lời đúng nhất cho các câu hỏi sau:
Câu 1: Ở trạng thái bình thường, nguyên tử trung hòa về điện vì:
A. số p = số n
B. số n = số e
C. số e = số p
D. tất cả đều đúng
Câu 2: Công thức hóa học nào sau đây viết đúng?
A. NaO2
B. CO3
C. AgO
D. Al2O3
Câu 3: Khi thổi hơi thở nhẹ vào ống nghiệm đựng nước vôi trong, hiện tượng quan sát được là:
A. sủi bọt khí
B. nước vôi trong bị đục
C. nước vôi trong vẫn trong suốt
D. nước vôi trong chuyển sang màu hồng
Câu 4: Phương trình hóa học dung để biểu diễn ngắn gọn:
A. một phân tử
B. kí hiệu hóa học
C. công thức hóa học
D. phản ứng hóa học
Câu 5: Hai chất khí khác nhau có cùng 1 mol, được đo ở cùng điều kiên nhiệt độ và áp suất như nhau thì thể tích của hai chất khí này như thế nào?
A. bằng nhau
B. bằng nhau và bằng 22,4 lít
C. khác nhau
D. không thể xác định được
Câu 6: Công thức hóa học của một chất cho ta biết:
A. Phân tử khối của chất.
B. Các nguyên tố cấu tạo nên chất.
C. Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
D. Tất cả đều đúng.
Câu 7: Phân tử khối của canxi cacbonat CaCO3 và sắt(III) sunfat Fe2(SO4)3 lần lượt là:
A. 197 và 342
B. 100 và 400
C. 197 và 234
D. 400 và 100
II. PHẦN TỰ LUẬN
Câu 1: Chọn những từ hoặc cụm từ thích hợp điền vào chỗ trống:
_____ là quá trình biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là _____, còn _____ mới sinh ra gọi là _____. Trong úa trình phản ứng, lượng chất _____ giảm dần, còn lượng chất_____ tang dần.
Câu 2: Tính khối lượng của:
0,15 mol CuSO4 (Cho Cu=64, S=32, O=16)
5,6 lít khí CO2 (đktc) (Cho C=12, O=16)
Câu 3: Hãy lập các phương trình hóa học sau đây:
Fe + Cl2 −to→ FeCl3
P2O5 + H2O → H3PO4
CO2 + KOH → K2CO3 + H2O
Al2O3 + HCl → AlCl3 + H2O
Câu 4: Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro.
Lập công thức hóa học của muối kẽm clorua. Biết kẽm clorua do hai nguyên tố là Zn và Cl tạo ra.
Tính khối lượng muối kẽm clorua tạo thành.
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 6
I. TRẮC NGHIỆM
Câu 1: chọn C
Hướng dẫn: Số proton mang điện dương và số electron mang điện âm.
Câu 2: chọn D
Hướng dẫn: Áp dụng quy tắc hóa trị để suy ra công thức đúng.
Câu 3: chọn B
Hướng dẫn: Trong hơi thở có khí CO2 nên làm đục nước vôi trong theo phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 4: chọn D
Câu 5: chọn A
Hướng dẫn: Các khí khác nhau được ở cùng điều kiện về: nhiệt độ và áp suất thì có cùng số mol => thể tích bằng nhau.
Câu 6: chọn D
Câu 7: chọn B
Hướng dẫn: +) CaCO3 : 40 + 12 + 16 x 3 = 100 đvC
+) Fe2(SO4)3 : 56 x 2 + (32 + 16 x 4) x 3 = 400 đvC
II. TỰ LUẬN
Câu 1:
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác. Chất biến đổi trong phản ứng gọi là chất phản ứng, còn chất mới sinh ra gọi là sản phẩm. Trong quá trinh phản ứng, lượng chất phản ứng giảm dần, còn lượng chất sản phẩm tang dần.
a) Khối lượng của CuSO4: m = n.M = 0,15.160 = 24 (gam)
b) Số mol CO2: n =V/22,4= 5,6/22,4 = 0,25 (mol)
Khối lượng của CO2: m = n.M = 0,25.44 = 11 (gam)
Câu 2: Các phương trình hóa học :
2Fe + 3Cl2 −to→ 2FeCl3
P2O5 + 3H2O → 2H3PO4
CO2 + 2KOH → K2CO3 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Câu 3:
a) Lập công thức hóa học của muối kẽm clorua: ZnCl2
b) Khối lượng muối ZnCl2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 7)I. TRẮC NGHIỆM
Khoanh tròn chữ cái cho câu trả lời.
Câu 1: Trong công thức hóa học nào dưới đây sắt có hóa trị III?
A. FeO
B. Fe2O3
C. Fe3O4
D. FeO hoặc Fe3O4
Câu 2: Hiện tượng nào sau đây là biến đổi hóa học?
A. Nước đá tan chảy
B. Muối ăn tan trong nước tạo thành nước muối
C. Cồn để trong lọ không kín bị bay hơi
D. Sắt bị gỉ sét tạo thành sắt oxit
Câu 3: Ở cùng một điều kiện về nhiệt độ và áp suất, số mol bất kì chất khí nào cũng có thể tích:
A. bằng nhau
B. 22 lít
C. 22,4 lít
D. 24 lít
Câu 4: Hợp chất là những chất tạo nên:
A. từ một chất duuy nhất
B. từ một nguyên tố hóa học
C. từ nhiều chất khác nhau
D. từ hơn một nguyên tố hóa học
Câu 5: Trong công thức hóa học của hidro sunfat H2S và khí sunfurơ SO2, hóa trị của lưu huỳnh lần lượt là:
A. I và II
B. II và IV
C. IV và II
D. đều là II
Câu 6: Dãy nguyên tố hóa học nào dưới đây đều là kim loại?
A. Fe, Cu, Al
B. Fe, S, Cu
C. Fe, C, Al
D. Fe, Cu, H
II. TỰ LUẬN
Câu 1: Chọn hệ số thích hợp để cân bằng các phản ứng háo học sau:
Na + Cl2 −to→ NaCl
SO2 + O2 −to→ SO3
Fe + HCl → FeCl2 + H2
Al(OH)3 −to→ Al2O3 + H2O
Câu 2: Tính số mol trong các hợp chất sau:
8 gam đồng oxit (CuO).
300 gam sắt (III) sunfat (Fe2(SO4)3).
Ở điều kiện tiêu chuẩn, hãy tính thể tích của:
2 mol khí hidro.
16 gam khí oxi.
Cho biết nguyên tử khối của một số nguyên tố hóa học:
S=32, O=16, Cu=64, Fe=56.
Câu 3: Áp dụng công thức tính tỉ khối, hãy tính:
Tỉ khối của khí oxi (O2) đối với khí hidro (H2).
Khối lượng mol khí A có tỉ khối đối với không khí là 2,207.
Câu 4: Đốt cháy 24 gam magie (Mg) với oxi (O2) trong không khí thu được 40 gam magie oxit (MgO). Phản ứng hóa học có phương trinh chữ như sau:
Magie + oxi → magie oxit
Lập phương trình hóa học và viết công thức về khối lượng của phản ứng xảy ra.
Tính khối lượng khí oxi đã phản ứng
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 7
I. TRẮC NGHIỆM
Câu 1: chọn B
Hướng dẫn: +) FeO : a x 1 = II x 1 → a = II (loại)
+) Fe2O3 : b x 2 = II x 3 → b = III (nhận)
+) Fe3O4 : c x 3 = II x 4 → c = 8/3 (loại)
Câu 2: chọn D
Hướng dẫn: Quá trình biễn đổi chất này thành chất khác gọi là hiện tượng hóa học.
Câu 3: chọn A
Câu 4: chọn D
Hướng dẫn: Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên.
Câu 5: chọn B
Hướng dẫn: +) Trong H2S: I x 2 = a x 1 → a = II
+) SO2: b x 1 = II x 2 → b = IV
Câu 6: chọn A
II. TỰ LUẬN
Câu 1: Cân bằng các phản ứng hóa học:
2Na + Cl2 −to→ 2NaCl
2SO2 + O2 −to→ 2SO3
Fe + 2HCl → FeCl2 + H2↑
2Al(OH)3 −to→ Al2O3 + 3H2O
Câu 2: Tính số mol trong các lượng chất:
8 gam đồng oxit: n = m/M= 8/80 = 0,1 (mol)
300 gam Fe2(SO4)3: n = m/M= 300/400 = 0,75 (mol)
2 mol khí hidro: V = n.22,4 = 2.22,4 = 44,8 (lít)
16 gam khí oxi: n = m : M = 16 : 32 = 0,5 (mol)
V = n.22,4 = 0,5.22,4 = 11,2 (lít)
Câu 3: Áp dụng công thức tính tỉ khối, ta có:
Tỉ khối của khí oxi (O2) đối với khí hidro (H2):
Khối lượng mol khí A có tỉ khối với không khí là 2,207:
dA/kk = MA/29 → MA = d.29 = 2,207.29 = 64 (gam)
Câu 4:
Lập phương trình hóa học và viết công thức về khối lượng của các chất trong phản ứng: 2Mg + O2 → 2MgO
mMg+ mO2= mMgO
Khối lượng oxi phản ứng: mO2= mMgO- mMg= 40 – 24 = 16 (gam)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 8)I. TRẮC NGHIỆM
Khoanh tròn vão chữ A hoặc B, C, D trước phương án chọn đúng.
Câu 1: Cho những oxit sau: SO2, K2O, CaO, N2O5, P2O5, BaO. Dãy gồm những oxit tác dụng với H2O, tạo ra bazơ là:
A. SO2, CaO, K2O
B. K2O, N2O5, P2O5
C. CaO, K2O, BaO
D. K2O, SO2, P2O5
Câu 2: Những oxit sau: CaO, SO2, Fe2O3, Na2O, CO2, P2O5. Dãy gồm nhưungx oxit tác dụng với nước tạo ra axit là:
A. CaO, SO2, Fe2O3
B. SO2, Na2O, CaO
C. SO2, CO2, P2O5
D. CO2, Fe2O3, P2O5
Câu 3: Cho các bazơ sau: LiOH, NaOH, KOH, Ca(OH)2, Mg(OH)2, Al(OH)3, Fe(OH)3. Dãy bazơ tan trong nước tạo thành dung dịch kiềm là:
A. Ca(OH)2, LiOH, Cu(OH)2, Mg(OH)2
B. Ca(OH)2, KOH, LiOH, NaOH
C. KOH, LiOH, NaOH, Al(OH)3
D. Al(OH)3, NaOH, Mg(OH)2, KOH
Câu 4: Có những chất rắn sau: FeO, P2O5, Ba(OH)2, NaNO3. Thuốc thử được chọn để phân biệt các chất trên là:
A. H2SO4, giấy quỳ tím.
B. H2O, giấy quỳ tím.
C. dung dịch NaOH, giấy quỳ tím.
D. dung dịch HCl, giấy quỳ tím.
Câu 5: Độ tan của một chất trong nước ở nhiệt độ xác định là:
A. số gam chất tan tan trong 100 gam nước.
B. số gam chất tan tan trong 100 gam dung môi.
C. số gam chất tan tan trong 1 lít nước để tạo thành dung dịch bão hòa.
D. số gam chất tan tan được trong 100 gam nước để tạo thành dung dịch bão hòa.
Câu 6: Dãy hợp chất gồm các chất thuộc loại muối là:
A. Na2O, CuSO4, KOH
B. CaCO3, MgO, Al2(SO4)3
C. CaCO3, CaCl2, FeSO4
D. H2SO4, CuSO4, Ca(OH)2
II. TỰ LUẬN
Câu 7: Viết phương trình hóa học biểu diễn dãy biến hóa sau:
a) S → SO2 → H2SO3
b) Ca → CaO → Ca(OH)2
Câu 8: Ở 20ºC, hòa tan 60 gam KNO3 vào 190 gam H2O thì thu được dung dịch bão hòa. Hãy tính độ tan của KNO3, ở nhiệt độ đó.
Câu 9: Tính khối lượng khí oxi cần dùng để đốt cháy hoàn toàn 1 tấn than (chứa 95% cacbon). Những tạp chất còn lại không cháy được.
(Biết H=1, C=12, O=16, Fe=56, K=39, N=14).
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 8
I. TRẮC NGHIỆM
Câu 1: chọn C
Chỉ có oxit kim loại (K2O, BaO, CaO) tác dụng với nước tạo ra bazơ tương ứng.
Câu 2: chọn C
Chỉ có những oxit axit mới tác dụng với nước tạo ra dung dịch axit tương ứng.
Câu 3: chọn B
Chỉ có 5 bazơ tan trong nước tạo ra dung dịch bazơ là: LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2.
Câu 4: chọn B
Cho nước lần lượt vào các chất rắn. Chất rắn không tan là FeO, các chất còn lại tan. P2O5 + 3H2O 2H3PO4
Nhúng quỳ tím vào các dung dịch thu được:
+) Dung dịch làm quỳ tím hóa đỏ là sản phẩm của P2O5
+) Dung dịch làm quỳ tím hóa xanh là Ba(OH)2
+) Dung dịch không có hiện tượng gì là NaNO3
Câu 5: chọn D
Câu 6: chọn C
Muối là hợp chất hóa học gồm một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit.
II. TỰ LUẬN
Câu 7:
Câu 8: Cứ 190 gam H2O hòa tan hết 60 gam KNO3 tạo dung dịch bão hòa
100 gam H2O hòa tan hết x gam KNO3.
Câu 9: Khối lượng C có trong 1 tấn than là:
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 9)I. TRẮC NGHIỆM
Hãy khoanh tròn một trong các chữ cái (A, B, C, D) đứng trước câu trả lời đúng nhất.
Câu 1: Phương pháp chứng cất được dung để tách một hỗn hợp gồm:
A. nước với muối ăn
B. nước với rượu
C. cát với đường
D. bột sắt với lưu huỳnh
Câu 2: Cho các công thức hóa học của một số chất như sau: oxi O2, bạc clorua AgCl, magie oxit MgO, kim loại đồng Cu, kali nitrat KNO3, natri hidroxit NaOH.
Trong các chất trên có mấy đơn chất, mấy hợp chất?
A. 3 đơn chất và 3 hợp chất
B. 1 đơn chất và 5 hợp chất
C. 4 đơn chất và 2 hợp chất
D. 2 đơn chất và 4 hợp chất
Câu 3: hai nguyên tử khác nhau, muốn có cùng kí hiệu hóa học phải có tính chất:
A. cùng số elctron trong nhân
B. cùng số nowtron trong nhân
C. cùng số proton trong nhân
D. cùng khối lượng
Câu 4: Từ công thức hóa học K2CO3 cho biết ý nào đúng?
Hợp chất trên do 3 đơn chất K, C, O tạo nên.
Hợp chất trên do 3 nguyên tố K, C, O tạo nên.
Hợp chất trên có phân tử khối 138 đvC (K=39, c=12, O=16).
Hơp chất trên là hỗn hợp 3 chất kali, cacbon, oxi.
A. 1, 2, 3
B. 2, 3, 4
C. 1, 4
D. 2, 3
Câu 5: Theo hóa trị của sắt trong Fe2O3, hãy chọn công thức hóa học đúng của hợp chất gồm Fe liên kết với nhóm nguyên tử SO4(II).
A. Fe2(SO4)3
B. FeSO4
C. Fe3(SO4)2
D. Fe2SO4
Câu 6: Phải lấy bao nhiêu gam kim loại sắt để có số nguyên tử nhiều gấp 2 lần số nguyên tử có trong 8 gam lưu huỳnh?
A. 29 gam
B. 28 gam
C. 28,5 gam
D. 56 gam
II. TỰ LUẬN
Câu 7:
Tính hóa trị của nguyên tố P trong hợp chất P2O5.
Lập công thức hóa học và tính khối lượng mol của hợp chất gồm Al(III) lien kết với nhóm SO4(II). (Al=27, S=32, O=16)
Câu 8: Cho sơ đồ các phản ứng sau:
Al + O2 −to→ Al2O3
P2O5 + H2O H3PO4
KClO3 −to→ KCl + O2
Na + H2O → NaOH + H2
H2 + Fe2O3 −to→ Fe + H2O
Mg + HCl → MgCl2 + H2
Hãy chọn hệ số và viết thành phương trình hóa học.
Câu 9: Tìm khối lượng của 1,8.1023 phân tử CO2 và cho biết lượng chất trên chiếm thể tích bao nhiêu ml (đo ở đktc)? (C=12, O=16)
Đáp án đề thi Học kì 1 môn Hóa học 8 - Đề số 9
I. TRẮC NGHIỆM
Câu 1: chọn B
Hướng dẫn: Phương pháp chưng cất dung để tách hai chất lỏng ra khỏi nhau (nhiệt độ sôi khác nhau nhiều).
Câu 2: chọn D
Hướng dẫn: +) Đơn chất là những chất được tạo nên từ 1 nguyên tố hóa học.
+) Hợp chất là những chất được tạo nên từ 2 nguyên tố hóa học trở lên.
Câu 3: chọn C
Câu 4: chọn D
Câu 5: chọn A
Hướng dẫn: +) Từ Fe2O3 → Fe có hóa trị III.
+) Fex(SO4)y. Áp dụng quy tắc hóa trị, ta có:
III.x = II.y → x/y=II/III=2/3
→ CTHH: Fe2(SO4)3.
Câu 6: chọn B
Hướng dẫn: Ta có: nS = 8/32 = 0,25 (mol)
Số nguyên tử Fe = 2 x số nguyên tử S
nFe = 2 x nS = 2 x 0,25 = 0,5 (mol)
MFe = 0,5 x 56 = 28 (gam)
II. TỰ LUẬN
Câu 7:
Gọi t là hóa trị của P trong P2O5
Theo quy tắc hóa trị: 2 x t = 5 x II → t = V
Alx(SO4)y
Theo quy tắc hóa trị: x.III = y.II → x/y = II/III= 2/3
x=2, y=3 → CTHH: Al2(SO4)3
M = 27.2 + (32 + 16.4).3 = 342 (gam)
Câu 8:
4Al + 3O2 −to→ 2Al2O3
P2O5 + 3H2O → 2H3PO4
2KClO3 −to→ 2KCl + 3O2 ↑
Na + H2O → NaOH + 1/2 H2 ↑
3H2 + Fe2O3 −to→ 2Fe + 3H2O
Mg + 2HCl → MgCl2 + H2 ↑
Câu 9: Ta có: nCO2= (1,8.1023)/(6.1023) = 0,3 (mol)
mCO2=0,3 x 44=13,2 (gam)
Và VCO2= 0,3 x 22,4 = 6,72 (lit) = 6720 (ml)
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 10)Câu 1: Hỗn hợp có thể tách riêng các chất thành phần bằng phương pháp lọc là:
A. Đường và muối.
B. Bột than và bột sắt.
C. Cát và muối.
D. Giấm và rượu
Câu 2: Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
A. 2 chất trở lên
B. 3 chất
C. 4 chất
D. 2 chất
Câu 3: Tính chất nào sau đây cho ta biết đó là chất tinh khiết?
A. Không màu, không mùi.
B. Có vị ngọt, mặn hoặc chua.
C. Không tan trong nước.
D. Khi đun thấy sôi ở nhiệt độ xác định.
Câu 4: Hạt nhân nguyên tử được tạo bởi?
A. proton, nơtron.
B. proton, electron.
C. electron.
D. electron, nơtron.
Câu 5: Dãy chất nào sau đây chỉ kim loại?
A. Đồng, bạc, nhôm, magie.
B. Sắt, lưu huỳnh, cacbon, nhôm.
C. Cacbon, lưu huỳnh, photpho, oxi.
D. Bạc, oxi, sắt, nhôm.
Câu 6: Cho các chất có công thức hóa học sau: Na, O3, CO2, Cl2, NaNO3, SO3. Dãy công thức gồm các hợp chất là?
A. Na, O3, Cl2.
B. CO2, NaNO3, SO3.
C. Na, Cl2, CO2.
D. Na, Cl2, SO3.
Câu 7: Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố.
B. Từ 3 nguyên tố.
C. Từ 4 nguyên tố trở lên.
D. Từ 1 nguyên tố.
Câu 8: Dựa vào dấu hiện nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
A. Hình dạng của phân tử.
B. Kích thước của phân tử.
C. Số lượng nguyên tử trong phân tử.
D. Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Câu 9: Biết Ca (II) và PO4 (III), vậy công thức hóa học đúng là:
A. CaPO4.
B. Ca3PO4.
C. Ca3(PO4)2.
D. Ca(PO4)2.
Câu 10: Ý nghĩa của công thức hóa học là?
A. Nguyên tố nào tạo ra chất
B. Phân tử khối của chất
C. Số nguyên tử mỗi nguyên tố có trong 1 phân tử của chất
D. Tất cả đáp án
Câu 11: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là
A. I
B. III
C. II
D. IV
Câu 12: Phản ứng hoá học là quá trình biến đổi
A. Trạng thái tồn tại của chất.
B. Nguyên tử này thành nguyên tử khác
C. Chất này thành chất khác.
D. Nguyên tố này thành nguyên tố khác.
Câu 13: Đốt cháy than (C) trong oxi dư, thấy có khí cacbonic (CO2) thoát ra. Sản phẩm của phản ứng là:
A. Than
B. Khí cacbonic
C. Khí oxi
D. Than và khí oxi
Câu 14: Cho phương trình hóa học sau SO3 + H2O → H2SO4. Chất tham gia là?
A. SO3, H2SO4.
B. H2SO4.
C. H2O, H2SO4.
D. SO3, H2O.
Câu 15: Hiện tượng nào là hiện tượng vật lí?
A. Đập đá vôi sắp vào lò nung.
B. Làm sữa chua.
C. Muối dưa cải.
D. Sắt bị gỉ.
Câ 16: Phản ứng nào sau đây được cân bằng chưa đúng?
A. CaO + H2O → Ca(OH)2.
B. S + O2 → SO2.
C. NaOH + HCl → NaCl + H2O.
D. Cu(OH)2 + 2HCl → CuCl2 + H2O.
Câu 17: Trong các cách phát biểu về định luật bảo toàn khối lượng như sau, cách phát biểu nào đúng:
A. Tổng sản phẩm các chất bằng tổng chất tham gia
B. Trong một phản ứng, tổng số phân tử chất tham gia bằng tổng số phân tử chất tạo thành
C. Trong một phản ứng hoá học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.
D. Không phát biểu nào đúng.
Câu 18: Cho phản ứng hóa học: A + B + C → D. Chọn đáp án đúng:
A. mA + mB = mC + mD
B. mA + mB + mC = mD
C. mA + mC = mB + mD
D. mA = mB + mC + mD
Câu 20: Đốt cháy 5 gam cacbon trong khí oxi, ta thu được 21 gam khí cacbonic. Khối lượng khí oxi cần dùng là:
A. 8 gam
B. 16 gam
C. 28 gam
D. 32 gam
Câu 21: Đốt cháy 1,5 gam kim loại Mg trong không khí thu được 2,5 gam hợp chất magie oxit MgO. Khối lượng khí oxi đã phản ứng là:
A. 1 gam
B. 1,2 gam
C. 1,5 gam
D. 1,1 gam
Câu 22: Cho phương trình hóa học: Fe + O2 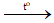
A. 1 : 2 : 1
B. 3 : 2 : 1
C. 3 : 4 : 1
D. 1 : 4 : 1
Câu 23: Cho sơ đồ phản ứng sau: BaCO3 + HCl ⇢ BaCl2 + H2O + CO2
Chọn nhận định đúng, sau khi lập phương trình hóa học
A. Tỉ lệ phân tử BaCO3 : HCl = 2 : 1
B. Tỉ lệ phân tử BaCO3 : HCl = 1 : 2
C. Hệ số cân bằng của Na2CO3 , BaCl2, BaCO3, NaCl lần lượt là 1, 1, 1, 2.
D. Tỉ lệ phân tử BaCO3 : HCl = 3 : 1
Câu 24: Chất nào sau đây nặng hơn không khí?
A. SO2.
B. H2.
C. CH4.
D. N2.
Câu 25: Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là:
A. 32 g/mol.
B. 34 g/mol.
C. 36 g/mol.
D. 28 g/mol.
Câu 26: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Câu 27: Tính khối lượng khí H2 có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,6 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 28: Thành phần phần trăm theo khối lượng của nguyên tố Fe có trong hợp chất Fe2O3 là:
A. 70%
B. 30%
C. 40%
D. 60%
Câu 29: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là
A. KO2
B. KO
C. K2O
D. KOH
Câu 30: Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
A. SO.
B. SO2.
C. SO3.
D. H2SO4.
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 11)Câu 1: Chất tinh khiết là chất
A. có tính chất không đổi.
B. có lẫn thêm vài chất khác.
C. gồm những phân tử đồng dạng.
D. không lẫn tạp chất.
Câu 2: Nguyên tử sắt có điện tích hạt nhân là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của sắt là:
A. 26
B. 48
C. 56
D. 65
Câu 3: Trong nguyên tử, hạt mang điện là
A. hạt proton, hạt nơtron
B. hạt proton, hạt electron
C. hạt nhân, proton và hạt electron
D. hạt nhân
Câu 4: Nguyên tử trung hòa về điện vì
A. Số proton bằng số nơtron
B. Số proton xấp xỉ số electron
C. Có cùng số proton
D. Số proton bằng số electron
Câu 5: Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố.
B. Từ 3 nguyên tố.
C. Từ 4 nguyên tố trở lên.
D. Từ 1 nguyên tố.
Câu 6: Cho những chất sau: Than chì (C), muối ăn (NaCl), khí ozon (O3), sắt (Fe), nước đá (H2O), khí oxi (O2), đá vôi (CaCO3). Có bao nhiêu hợp chất?
A. 1
B. 3
C. 5
D. 4
Câu 7: Phân tử khối của H2SO4 là:
A. 9 đvC
B. 50 đvC
C. 96 đvC.
D. 98 đvC.
Câu 8: Phân tử oxi có kí hiệu hóa học là:
A. O
B. O2
C. O3
D. O2
Câu 9: Hoá trị của Al trong các hợp chất AlCl3 (biết Cl có hoá trị I) là
A. I
B. II
C. III
D. IV
Câu 10: Biết Ba có hóa trị II và gốc (PO4) có hóa trị III. Vậy công thức hóa học của hợp chất tạo bởi nguyên tố Ba và gốc (PO4) là:
A. BaPO4
B. Ba2PO4
C. Ba3PO4
D. Ba3(PO4)2.
Câu 11: Cho phương trình hóa học: Fe + 2HCl → FeCl2 + H2↑. Chất tham gia phản ứng gồm:
A. Fe và H2.
B. Fe và HCl.
C. FeCl2 và H2.
D. HCl và FeCl2.
Câu 12: Thành phần phần trăm khối lượng của nguyên tố Na có trong Na2SO4 là
A. 25%.
B. 32,39%.
C. 31,66%.
D. 38%.
Câu 13: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
Câu 14: Hiện tượng nào sau đây là hiện tượng hóa học:
A. Bóng đèn điện sáng.
B. Thức ăn bị ôi thui
C. Cốc thủy tinh bị vỡ.
D. Muối ăn tan trong nước
Câu 15: Đâu là hiện tượng vật lí trong các hiện tượng sau:
A. Mặt trời mọc, sương tan dần.
B. Quá trình quang hợp của cây xanh.
C. Chưng đường ngả màu nâu đen.
D. Thức ăn bị ôi thiu.
Câu 16: Sắt cháy trong oxi, không có ngọn lửa nhưng sáng chói tạo ra hạt nhỏ nóng chảy màu nâu là oxit sắt từ, phương trình chữ của phản ứng hóa học là:
Câu 17: Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, phân tử của phản ứng: Na + O2 ⇢ Na2O?
A. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 4 : 1 : 2
B. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 1 : 1 : 1
C. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 2 : 1 : 2
D. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 2 : 1 : 1
Câu 18: Biết rằng kim loại Ba tác dụng với axit clohiđric tạo ra khí hiđro H2 và bari clorua BaCl2. Chọn nhận định đúng?
A. Phương trình phản ứng sau cân bằng Ba + HCl → BaCl2 + H2
B. 1 nguyên tử Ba phản ứng với 2 phân tử HCl
C. số phân tử Ba phản ứng bằng số phân tử H2 phản ứng
D. hệ số phản ứng sau khi cân bằng của Ba; HCl; BaCl2; H2 lần lượt là 1; 1; 1; 1
Câu 19: Đốt cháy m gam chất Y cần dùng 6,4 gam oxi thu được 4,4 gam khí CO2 và 3,6 gam H2O. Khối lượng m có giá trị nào sau đây:
A. 1,8 gam
B. 3,4 gam
C. 1,6 gam
D. 1,7 gam
Câu 20: Chọn đáp án đúng
A. Tổng khối lượng sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
B. Tổng khối lượng sản phẩm nhỏ hơn tổng khối lượng các chất tham gia phản ứng.
C. Tổng khối lượng sản phẩm lớn hơn tổng khối lượng các chất tham gia phản ứng.
D. Tổng khối lượng sản phẩm nhỏ hơn hoặc bằng tổng khối lượng các chất tham gia phản ứng.
Câu 21: Phương trình hoá học nào dưới đây biểu diễn đúng phản ứng cháy của rượu etylic tạo ra khí cacbon và nước.
Câu 22: Câu nào sau đây đúng?
A. Trong phản ứng hoá học, các nguyên tử bị phá vỡ.
B. Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ.
C. Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ.
D. Trong phản ứng hoá học, các phân tử được bảo toàn.
Câu 23: Cho sơ đồ phản ứng: Al(OH)y + H2SO4 → Alx(SO4)y + H2O
Với x # y thì giá trị thích hợp của x, y lần lượt là:
A. 1 và 2
B. 2 và 3
C. 2 và 4
D. 3 và 4
Câu 24: A là oxit của lưu huỳnh có tỉ khối hơi so với phân tử oxi là 2. Vậy A có công thức phân tử là:
A. S
B. SO2
C. SO3
D. NO2
Câu 25: Khí N2 nặng hơn khí H2 bằng bao nhiêu lần?
A. 10 lần.
B. 12 lần.
C. 8 lần.
D. 14 lần.
Câu 26: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Câu 27: Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
A. SO.
B. SO2.
C. SO3.
D. H2SO4.
Câu 28: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là:
A. KO2
B. KO
C. K2O
D. KOH
Câu 29: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%.
B. 68,8%.
C. 76%.
D. 62,5%.
Câu 30: 0,5 mol khí CO2 đo ở điều kiện tiêu chuẩn (đktc) có thể tích là:
A. 22,4 lít
B. 11,2 lít
C. 44,8 lít
D. 24 lít.
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 12)Câu 1: Đâu là chất tinh khiết trong các chất sau?
A. Nước khoáng
B. Nước mưa
C. Nước lọc
D. Nước cất
Câu 2: Một nguyên tử có 17 electron, cấu tạo của nguyên tử đó có bao nhiêu lớp electron?
A. 2
B. 3
C. 1
D. 4
Câu 3: Tính chất nào của chất trong số các tính chất sau đây có thể biết được bằng cách quan sát trực tiếp mà không cần dụng cụ đo hay làm thí nghiệm:
A. Màu sắc.
B. Tính tan trong nước.
C. Khối lượng riêng.
D. Dẫn nhiệt, dẫn điện.
Câu 4: Nguyên tử sắt có điện tích hạt nhân là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của sắt là:
A. 26
B. 48
C. 56
D. 65
Câu 5: Phân tử khối của HCl là
A. 35,5 đvC.
B. 36,5 đvC.
C. 71 đvC.
D. 73 đvC.
Câu 6: Trong số các công thức hóa học sau: O2, N2, Al, Al2O3, H2, AlCl3, H2O, P. Số đơn chất là:
A. 4
B. 3
C. 5
D. 6
Câu 7: Dãy chất nào sau đây đều là hợp chất:
A. Cl2, KOH, H2SO4, AlCl3.
B. CuO, KOH, H2SO4, AlCl3.
C. CuO, KOH, Fe, H2SO4.
D. Cl2, Cu, Fe, Al.
Câu 8: Phân tử rượu etylic C2H5OH gồm mấy nguyên tử?
A. 10
B. 8
C. 9
D. 7
Câu 9: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là
A. I
B. III
C. II
D. IV
Câu 10: Nguyên tố X có hóa trị III, công thức hợp chất của X với nhóm SO4 (II) là
A. XSO4
B. X(SO4)3
C. X2(SO4)3
D. X3SO4
Câu 11: Hiện tượng hoá học khác với hiện tượng vật lý là:
A. Chỉ biến đổi về trạng thái.
B. Có sinh ra chất mới.
C. Biến đổi về hình dạng.
D. Khối lượng thay đổi.
Câu 12: Hiện tượng nào sau đây không phải là hiện tượng hóa học?
A. Đốt cháy đường.
B. Thở hơi thở vào dung dịch nước vôi trong thấy có xuất hiện vẩn đục.
C. Đốt cháy cồn tạo thành khí cacbonic và hơi nước.
D. Mực hòa tan vào nước.
Câu 13: Phát biểu nào sau đây không đúng về phản ứng hóa học?
A. Phản ứng hóa học xảy ra sự thay đổi liên kết giữa các nguyên tử.
B. Khi phản ứng hóa học xảy ra, lượng chất tham gia tăng dần theo thời gian phản ứng.
C. Một số phản ứng hóa học cần xúc tác để phản ứng xảy ra nhanh hơn.
D. Chất kết tủa hoặc chất khí bay lên là dấu hiệu thể hiện phản ứng hóa học xảy ra.
Câu 14: Cho sơ đồ phản ứng hóa học: N2 + H2 ⇢ NH3. Các hệ số đặt trước các phân tử N2, H2, NH3 lần lượt là
A. 1, 3, 2.
B. 1, 2, 3.
C. 2, 1, 3.
D. 3, 1, 2.
Câu 15: Cho phương trình phản ứng: aAl + bHCl → cAlCl3 + dH2. Các hệ số a, b, c, d nhận các giá trị lần lượt là:
A. 2, 6, 2, 3.
B. 2, 6, 3, 3.
C. 2, 6, 3, 2.
D. 6, 2, 2, 3.
Câu 16: Trong các mệnh đề sau, mệnh đề nào phản ánh bản chất của định luật bảo toàn khối lượng?
1. Trong phản ứng hoá học, nguyên tử được bảo toàn, không tự nhiên sinh ra và cũng không tự nhiên mất đi.
2. Tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng.
3. Trong phản ứng hoá học, nguyên tử không bị phân chia.
4. Số phân tử các chất sản phẩm bằng số phân tử các chất phản ứng.
A. 1 và 4
B. 1 và 3
C. 3 và 4
D. 1
Câu 17: Đốt cháy hoàn toàn 13,4 gam hỗn hợp X gồm: Fe, Al và Cu trong 2,24 lít khí O2 (đktc), sau phản ứng thu được m gam chất rắn. Giá trị của m là: (biết oxi phản ứng hết)
A. 16,6 gam.
B. 13,4 gam.
C. 22,2 gam.
D. 14,8 gam.
Câu 18: Tính thể tích của khí oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
A. 1,4 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 2,8 lít.
Câu 19: Trong phản ứng hóa học, các chất tham gia và các chất sản phẩm đều có cùng
A. số nguyên tử của mỗi nguyên tố.
B. số nguyên tố tạo nên chất.
C. số phân tử của mỗi chất.
D. số nguyên tử trong mỗi chất.
Câu 20: Trong phản ứng sau chất nào là sản phẩm ?
Axit clohiđric + kali cacbonat → kali clorua + cacbon đioxit + nước
A. Axit clohiđric, kali clorua.
B. Kali clorua, cacbon đioxit.
C. Cacbon đioxit, nước.
D. Kali clorua, cacbon đioxit, nước.
Câu 21: 0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
A. 10,2 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 22: Tính số mol phân tử có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,3mol
B. 0,5mol
C. 1,2 mol
D. 1,5mol
Câu 23: 1 mol khí cacbonic (CO2) có thể tích là bao nhiêu ở điều kiện tiêu chuẩn?
A. 24 lít
B. 2,24 lít
C. 22,4 lít
D. 4,48 lít
Câu 24: Phần trăm theo khối lượng của K trong phân tử K2CO3 là:
A. 56,502%
B. 56,52%
C. 56,3%
D. 56,56%
Câu 25: Thành phần phần trăm khối lượng của oxi trong Fe2O3 là:
A. 35%
B. 40%
C. 30%
D. 45%
Câu 26: Oxit chứa 20% oxi về khối lượng và trong đó nguyên tố chưa biết có hoá trị II. Oxit có công thức hoá học là:
A. MgO
B. ZnO
C. CuO
D. FeO
Câu 27: A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15, biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là
A. CH4
B. C3H6
C. C2H6
D. C2H2
Câu 28: Hỗn hợp khí CO và CO2 có tỉ khối so với O2 là 1. Thể tích khí CO2 cần thêm vào 8,96 lít hỗn hợp trên (đktc) để có tỉ khối so với O2 tăng lên bằng 1,075 là:
A. 2,24 lít
B. 1,12 lít
C. 11,2 lít
D. 22,4 lít
Câu 29: A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
A. SO2
B. CO2
C. SO3
D. NO2
Câu 30: Có thể thu được những khí nào vào bình (từ những thí nghiệm trong phòng thí nghiệm): khí H2, N2, CH4, O2 bằng cách đặt ngửa bình?
A. H2
B. CH4
C. N2
D. O2
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 13)Câu 1: Câu sau đây ý nói về nước cất: “Nước cất là chất tinh khiết, sôi ở 100oC”. Hãy chọn phương án đúng trong số các phương án sau:
A. Cả 2 ý đều đúng.
B. Cả 2 ý đều sai.
C. Ý 1 đúng, ý 2 sai.
D. Ý 1 sai, ý 2 đúng.
Câu 2: Trong hạt nhân nguyên tử, thì gồm những hạt nào?
A. Proton,electron.
B. Proton, notron
C. Electron.
D. Proton,electron, notron
Câu 3: Chọn đán án đúng nhất
A. Trong nguyên tử có số p = số e
B. Hạt nhân tạo bởi proton và electron
C. Electron không chuyển động quanh hạt nhân
D. Eletron chuyển động hỗn loạn và không sắp xếp theo từng lớp
Câu 4: Nguyên tử cacbon có điện tích hạt nhân là 6+. Số electron lớp ngoài cùng của cacbon là:
A. 6
B. 4
C. 2
D. 1
Câu 5: Cho dãy các chất có công thức hóa học: HCl, H2, NaOH, KMnO4, O2, N2, NaClO. Có bao nhiêu hợp chất?
A. 1
B. 2
C. 3
D. 4
Câu 6: Dựa vào dấu hiện nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
A. Hình dạng của phân tử.
B. Kích thước của phân tử.
C. Số lượng nguyên tử trong phân tử.
D. Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Câu 7: Phân tử khối của hợp chất Fe(OH)3 bằng:
A. 107 đvC.
B. 107 gam.
C. 73 đvC.
D. 73 gam.
Câu 8: Những nguyên tố tạo nên canxi cacbonat (CaCO3) có trong vỏ trứng là:
A. Ba, C, O.
B. Ca, C, O.
C. K, C, O.
D. C, P, O.
Câu 9: Nguyên tử P có hóa trị V trong hợp chất nào sau đây?
A. P2O3
B. P2O5
C. P4O4
D. P4O10
Câu 10: Biết Cr hoá trị III và O hoá trị II. Công thức hoá học nào sau đây viết đúng?
A. Cr2O3
B. CrO
C. CrO2
D. CrO3
Câu 11: Đâu là hiện tượng hóa học trong các hiện tượng dưới đây?
A. Nước sôi
B. Nước bốc hơi
C. Nước đóng băng
D. Nước bị phân hủy tạo thành khí oxi và khí hiđro
Câu 12: Hiện tượng vật lí là hiện tượng chất biến đổi mà:
A. Có chất mới sinh ra.
B. Vẫn giữ nguyên là chất ban đầu.
C. Có chất rắn tạo thành.
D. Có chất khí tạo thành.
Câu 13: Dấu hiệu của phản ứng hóa học xảy ra là:
A. Thay đổi màu sắc
B. Tạo chất bay hơi
C. Tạo chất kết tủa
D. Tất cả đáp án
Câu 14: Có phương trình hóa học sau:
Tỉ lệ số nguyên tử, phân tử của các chất trong phương trình bằng:
A. 2 : 3 : 2 : 3.
B. 2 : 3 : 1 : 2.
C. 2 : 3 : 1 : 3.
D. Kết quả khác.
Câu 15: Biết rằng kim loại Mg tác dụng với axit sunfuric H2SO4 tạo ra khí hiđro (H2) và chất magie sunfat MgSO4. Chọn nhận định đúng
A. Phương trình phản ứng sau cân bằng: Mg + H2SO4 → MgSO4 + H2
B. 1 nguyên tử Mg phản ứng với 2 phân tử H2SO4.
C. Số phân tử Mg phản ứng bằng số phân tử H2 phản ứng.
D. Hệ số phản ứng sau khi cân bằng của Mg, H2SO4, MgSO4, H2 lần lượt là 3; 2; 1; 1
Câu 16: Cho 13,2 gam hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18 gam hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
A. 3,2 gam.
B. 4,8 gam.
C. 9,6 gam.
D. 12,8 gam.
Câu 17: Cho phản ứng hóa học: A+ B + C → D. Chọn đáp án đúng:
A. mA + mB = mC + mD
B. mA + mB + mC = mD
C. mA + mC = mB + mD
D. mA = mB + mC + mD
Câu 18: Các câu sau, câu nào sai?
A. Trong phản ứng hóa học, khi chất biến đổi làm các nguyên tử bị biến đổi.
B. Trong phương trình hoá học, cần đặt hệ số thích hợp vào công thức của các chất sao cho số nguyên tử của mỗi nguyên tố ở 2 vế đều bằng nhau.
C. Trong phản ứng hoá học, biết tổng khối lượng của các chất phản ứng ta biết được tổng khối lượng các sản phẩm.
D. Trong phản ứng hoá học, màu sắc của các chất có thẻ bị thay đổi
Câu 19: Cho nhôm (Al) tác dụng với axit sunfuric (H2SO4) thu được muối nhôm sunfat (Al2(SO4)3) và khí H2. Phương trình phản ứng nào sau đây đã viết đúng?
A. Al + H2SO4 → Al2(SO4)3 + H2
B. 2Al + H2SO4 → Al2(SO4)3 + H2
C. Al + 3H2SO4 → Al2(SO4)3 + 3H2
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Câu 20: Khi nung đá vôi ở nhiệt độ cao người ta thu được các sản phẩm là cacbon đioxit và canxi oxit. Chọn phương trình chữ đúng với phản ứng trên?
A. Canxi oxit + cacbon đioxit → Canxi cacbonat
B. Canxi oxit → Canxi cacbonat + cacbon đioxit
C. Canxi cacbonat → Canxi oxit + cacbon đioxit
D. Canxi cacbonat + Canxi oxit → Cacbon đioxit
Câu 21: Thành phần phần trăm khối lượng của oxi trong Fe2O3 là:
A. 35%
B. 40%
C. 30%
D. 45%
Câu 22:Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là:
A. 2,24
B. 1,12
C. 3,36
D. 4,48
Câu 23: Một hợp chất khí có thành phần phần trăm theo khối lượng là: 82,35%N và 17,65% H. Công thức của hợp chất khí là:
A. N3H.
B. NH3.
C. NH2.
D. N2H
Câu 24: Phân tích một khối lượng của hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
A. SO2
B. SO3
C. SO4
D. S2O3
Câu 25: Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):
A. Khí cacbonic (CO2).
B. Khí oxi (O2).
C. Khí clo (Cl2).
D. Khí hiđro (H2).
Câu 26: A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
A. SO2
B. CO2
C. SO3
D. NO2.
Câu 27: Tỉ khối của hỗn hợp chứa N2 và O2 theo tỉ lệ về thể tích là 1:2 so với không khí là:
Câu 28: Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
Câu 29: Khối lượng của 1 mol nguyên tử Ag là:
A. 27 gam.
B. 35 gam.
C. 100 gam.
D. 108 gam.
Câu 30: Số mol nguyên tử tương ứng với 10,0 gam hợp chất CaCO3 là
A. 0,5 mol.
B. 10,0 mol.
C. 0,1 mol.
D. 0,25 mol.
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 14)Câu 1: Để tách rượu ra khỏi hỗn hợp rượu lẫn nước, dùng cách nào sau đây?
A. Lọc
B. Dùng phễu chiết
C. Chưng cất phân đoạn
D. Đốt
Câu 2: Việc hiểu biết tính chất của chất có lợi gì?
A. Giúp phân biệt chất này với chất khác, tức nhận biết được chất.
B. Biết cách sử dụng chất.
C. Biết ứng dụng chất thích hợp trong đời sống và sản xuất.
D. Cả ba ý trên.
Câu 3: Hầu hết các nguyên tử được cấu tạo bởi các hạt:
A. p và n.
B. n và e.
C. e và p.
D. n, p và e.
Câu 4: Chọn đáp án sai?
A. Khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
B. Trong nguyên tử, số proton và số electron bằng nhau.
C. Hạt nhân tạo bởi proton và nơtron.
D. Hạt mang điện tích âm là electron, hạt mang điện tích dương là nơtron.
Câu 5: Phân tử khối của CH4, Mg(OH)2, KCl lần lượt là
A. 16 đvC, 74,5 đvC, 58 đvC.
B. 74,5 đvC, 58 đvC, 16 đvC.
C. 17 đvC, 58 đvC, 74,5 đvC.
D. 16 đvC, 58 đvC, 74,5 đvC.
Câu 6: Đơn chất là chất được tạo nên từ:
A. một chất
B. một nguyên tố hóa học
C. một nguyên tử
D. một phân tử
Câu 7: Dãy chất nào sau đây đều là hợp chất:
A. Cl2, KOH, H2SO4, AlCl3.
B. CuO, KOH, H2SO4, AlCl3.
C. CuO, KOH, Fe, H2SO4.
D. Cl2, Cu, Fe, Al.
Câu 8: Chọn đáp án sai?
A. CO là phân tử gồm nguyên tố C và nguyên tố O.
B. Ca là công thức hóa học của canxi.
C. Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử.
D. Fe3O4 gồm 3 nguyên tử Fe và 4 nguyên tử O.
Câu 9: Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
A. N2O.
B. NO.
C. NO2.
D. N2O5.
Câu 10: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là:
A. I
B. III
C. II
D. IV
Câu 11: Trong 1 phản ứng hoá học, các chất phản ứng và sản phẩm giữ nguyên:
A. số nguyên tử của mỗi nguyên tố.
B. số phân tử trong mỗi chất.
C. số phân tử của mỗi chất.
D. số nguyên tố tạo ra chất.
Câu 12: Trong quá trình phản ứng, lượng chất phản ứng:
A. Giữ nguyên.
B. Tăng
C. Giảm dần
D. Cả A, B, C.
Câu 13: Cho các quá trình sau, đâu là quá trình hóa học?
A. Đường kính hòa tan vào nước tạo thành nước đường.
B. Nước đường cô cạn thành đường kính.
C. Đường kính nung nóng chảy ở nhiệt độ vừa phải tạo thành chất lỏng trong.
D. Đường nóng chảy ở nhiệt độ cao sau một thời gian chuyển thành than.
Câu 14: Biết rằng khí etilen C2H4 cháy là phản ứng xảy ra với oxi O2, sinh ra CO2 và nước. Lập phương trình hóa học của phản ứng và cho biết phát biểu nào sau đây sai?
A. số phân tử oxi : số phân tử etilen = 3 : 1.
B. số phân tử etilen : số phân tử cacbon đioxit = 1 : 2.
C. hệ số cân bằng của C2H4 , O2, CO2, H2O lần lượt là 1, 3, 2, 2.
D. số phân tử etilen : số nguyên tử oxi = 1 : 3.
Câu 15: Hãy điền hệ số thích hợp vào trước công thức hóa học để được phương trình hóa học đúng: …. H2 + …. O2 → …… H2O
A. 1, 2, 1.
B. 2, 1, 1.
C. 2, 1, 2.
D. 1, 2, 2.
Câu 16: Khi phản ứng hóa học xảy ra có chất mới tạo thành nhưng tổng khối lượng của các chất vẫn không đổi là vì:
A. Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi.
B. Trong phản ứng hóa học, số nguyên tử của mỗi nguyên tố trước và sau phản ứng thay đổi.
C. Trong phản ứng hóa học, liên kết giữa các nguyên tử trước và sau phản ứng thay đổi.
D. Trong phản ứng hóa học các phân tử thay đổi.
Câu 17: Trong các phương trình sau, phương trình nào cân bằng sai?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2H2 + O2 → 2H2O
C. 2Al + 3O2 → 2Al2O3
D. Zn + 2HCl → ZnCl2 + H2
Câu 18: Đốt cháy hoàn toàn 4,5 gam kim loại Mg trong khí oxi, sau phản ứng được 7,5 gam hợp chất MgO. Khối lượng của oxi đã tham gia phản ứng là
A. 12,0 gam.
B. 3,0 gam.
C. 4,5 gam.
D. 5,5 gam.
Câu 19: Cho phương trình: Cu + O2 ⇢ CuO. Phương trình cân bằng đúng là:
A.-2Cu + O2 → CuO
B. 2Cu + 2O2 → 4CuO
C. Cu + O2 → 2CuO
D. 2Cu + O2 → 2CuO
Câu 20: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
A. 11,2 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít.
Câu 21: Oxit chứa 20% oxi về khối lượng và trong đó nguyên tố chưa biết có hoá trị II. Oxit có công thức hoá học là:
A. MgO
B. ZnO
C. CuO
D. FeO
Câu 22: Phân tích một khối lượng hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
A. SO2
B. SO3
C. SO4
D. S2O3
Câu 23: Khí N2 nhẹ hơn khí nào sau đây?
A. H2.
B. NH3.
C. C2H2.
D. O2.
Câu 24: Hỗn hợp khí O2 và khí CO2 có tỉ khối đối với khí hiđro là 19, thành phần phần trăm các khí trong hỗn hợp lần lượt là:
A. 60% và 25%.
B. 75% và 40%.
C. 50% và 50%.
D. 70% và 30%.
Câu 25: Khí N2 nặng hơn khí H2 bằng bao nhiêu lần?
A. 10 lần.
B. 12 lần.
C. 8 lần.
D. 14 lần.
Câu 26: Tính khối lượng khí H2 có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,6 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 27: Ở điều kiện tiêu chuẩn, thể tích mol của các chất khí có giá trị là:
A. 2,24 lít
B. 22,4 lít
C. 0,224 lít
D. 24 lít.
Câu 28: Tính số mol nguyên tử có trong 9.10²³ nguyên tử oxi?
A. 1 mol
B. 5 mol
C. 1,2 mol
D. 1,5 mol
Câu 29:Phần trăm khối lượng của K trong phân tử K2CO3 là:
A. 56,502%
B. 56,52%
C. 56,3%
D. 56,56%
Câu 30: Tính phần trăm khối lượng C, biết trong 1 mol NaHCO3 có 1 mol Na, 1 mol C, 3 mol O và 1 mol H?
A. 14,28 %
B. 14,2%
C. 14,284%
D. 14,285%
_________________________________________________________________________
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 8 có đáp án - (Đề số 15)Câu 1: Tính chất nào của chất trong số các tính chất sau đây có thể biết được bằng cách quan sát trực tiếp mà không cần dụng cụ đo hay làm thí nghiệm:
A. Màu sắc.
B. Tính tan trong nước.
C. Khối lượng riêng.
D. Dẫn nhiệt, dẫn điện.
Câu 2: Có thể tách muối ra khỏi hỗn hợp nước muối bằng cách:
A. Thêm muối
B. Thêm nước
C. Đông lạnh
D. Đun nóng
Câu 3: Trong hạt nhân nguyên tử, thì gồm những hạt nào?
A. Proton, electron.
B. Proton, nơtron
C. Electron.
D. Proton, electron, nơtron
Câu 4: Vì sao nguyên tử có khả năng liên kết với nhau?
A. Do có electron.
B. Do có nơtron.
C. Tự dưng có sẵn.
D. Do khối lượng hạt nhân bằng khối lượng nguyên.
Câu 5: Khi đun nóng, đường bị phân hủy, biến đổi thành than (C) và nước (H2O). Như vậy, phân tử đường do những nguyên tử của nguyên tố nào tạo nên? Đường là đơn chất hay hợp chất?
A. Đường tạo nên từ 2 nguyên tố C và O. Đường là hợp chất.
B. Đường tạo nên từ 3 nguyên tố C, H và O. Đường là đơn chất.
C. Đường tạo nên từ nguyên tố C. Đường là đơn chất.
D. Đường tạo nên từ 3 nguyên tố C, H và O. Đường là hợp chất.
Câu 6: Trong số các công thức hóa học sau: O2, N2, Al, Al2O3, H2, AlCl3, H2O, P. Số đơn chất là
A. 4
B. 3
C. 5
D. 6
Câu 10: Chất có phân tử khối bằng nhau là (biết O = 16, N = 14, S = 32, C = 12):
A. O3 và N2.
B. CO và N2.
C. SO2 và O2.
D. NO2 và SO2.
Câu 11: Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
A. CuSO4 do 3 nguyên tố Cu, O, S tạo nên.
B. Có 3 nguyên tử oxi trong phân tử.
C. Có 2 nguyên tử S trong phân tử
D. Tất cả đáp án.
Câu 12: Công thức hóa học của nguyên tố nhôm Al (III) và gốc sunfat (SO4) (II) là
A. Al3(SO4)2.
B. Al2(SO4)3.
C. AlSO4.
D. Al2SO4.
Câu 13: Hoá trị của S, nhóm (PO4) trong các công thức hóa học sau: H2S và H3PO4 lần lượt là:
A. III và II.
B. I và III.
C. III và I.
D. II và III.
Câu 14: Trong các câu sau, câu nào chỉ hiện tượng hóa học:
A. Đinh sắt bị gỉ trong không khí.
B. Dây tóc bóng đèn sáng.
C. Cồn trong lọ bị bay hơi.
D. Nước bốc hơi.
Câu 15: Trong các hiện tượng sau, đâu là hiện tượng vật lí?
A. Điều chế nhôm (Al) nguyên chất từ quặng boxit (Al2O3).
B. Người ta để nước biển bay hơi thu được muối ăn.
C. Trứng để lâu ngày bị thối gây mùi rất khó chịu.
D. Làm sữa chua từ sữa tươi.
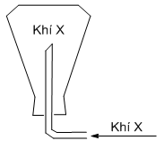
Câu 16: Cho sơ đồ phản ứng sau: Al + CuO ⇢ Al2O3 + Cu. Phương trình cân bằng đúng là:
Câu 17: Hiđro và oxi tác dụng với nhau tạo thành nước. Phương trình hoá học ở phương án nào dưới đây đã viết đúng?
Câu 18: Điều kiện để một phản ứng hóa học xảy ra là:
A. không thể thiếu chất xúc tác.
B. các chất phản ứng phải tiếp xúc với nhau.
C. cần phải đun nóng.
D. cả 3 điều kiện trên.
Câu 19: Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
Câu 20: Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
A. 4,83
B. 19,33
C. 33,18
D. 33,19
Câu 21: Dãy các chất khí đều nặng hơn không khí là:
A. SO2, Cl2, H2S.
B. N2, CO2, H2.
C. CH4, H2S, O2.
D. Cl2, SO2, N2.
Câu 22: Cho số mol của khí nitơ là 0,5 mol. Số mol của khí oxi là 0,5 mol. Kết luận nào sau đây là đúng?
A. Khối lượng của nitơ là 16.
B. Khối lượng của oxi là 14.
C. Nitơ và oxi có thể tích bằng nhau ở đktc.
D. Nitơ và oxi có khối lượng bằng nhau.
Câu 23: Nếu hai chất khí khác nhau mà có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì:
A. Chúng có cùng số mol chất.
B. Chúng có cùng khối lượng.
C. Chúng có cùng số phân tử.
D. Không thể kết luận được điều gì cả.
Câu 24: Tính khối lượng của Fe trong 92,8 gam Fe3O4?
A. 67,2 gam
B. 25,6 gam
C. 80 gam
D. 10 gam
Câu 25: Thành phần phần trăm khối lượng của sắt trong Fe2O3 là:
A. 35%
B. 65%
C. 30%
D. 70%
Câu 26: Tính số mol phân tử có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,3 mol
B. 0,5 mol
C. 1,2 mol
D. 1,5 mol
Câu 27: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là:
A. KO2
B. KO
C. K2O
D. KOH
Câu 28: A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15 biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là:
A. CH4
B. C3H6
C. C2H6
D. C2H2.
Câu 29: Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxi (đktc) đã dùng.
A. 51g và 16,8 lít
B. 51g và 33,6 lít
C. 51g và 22,4 lít
D. 102g và 16,8 lít
Câu 30: Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
A. 95%
B. 90%
C. 94%.
D. 85%.