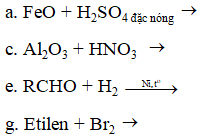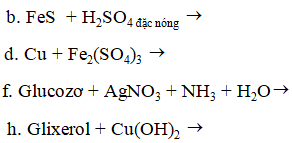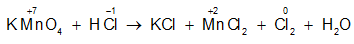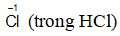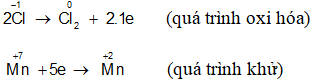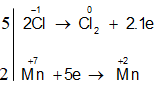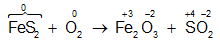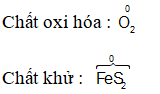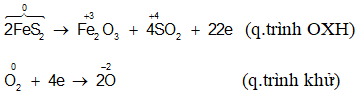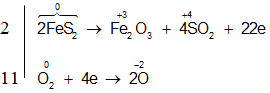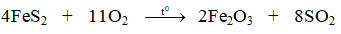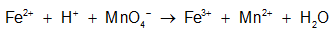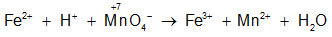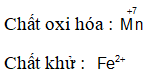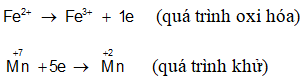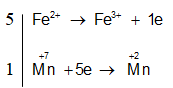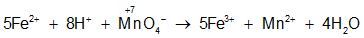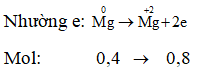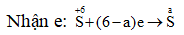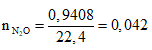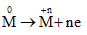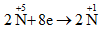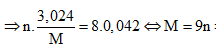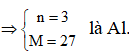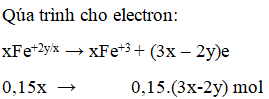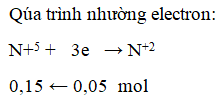4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học có lời giải
4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học có lời giải Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được 4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học có lời giải
4 dạng bài tập Phản ứng oxi hóa khử trong đề thi Đại học có lời giải
-
Dạng 1: Phân loại phản ứng hóa học
Phương pháp giải
-
* Phản ứng có sự thay đổi số oxi hóa và phản ứng không thay đổi số oxi hóa:
+ Phản ứng hóa hợp
+ Phản ứng thế
+ Phản ứng trao đổi
- Phân loại phản ứng oxi hóa khử: thông thường; nội phân tử ( chất khử và chất oxi hóa thuộc cùng một chất); tự oxi hóa khử ( chất khử và chất oxu hóa thuộc cùng một nguyên tối và cùng số oxi hóa ban đầu)
* Phản ứng tỏa nhiệt và phản ứng thu nhiệt

-
Ví dụ minh họa
Ví dụ 1: Cho các phản ứng oxi hoá – khử sau :
(1) 3I2 + 3H2O → HIO3 + 5HI
(2) HgO → 2Hg + O2
(3) 4K2SO3 → 3K2SO4 + K2S
(4) NH4NO3 → N2O + 2H2O
(5) 2KClO3 → 2KCl + 3O2
(6) 3NO2 + H2O → 2HNO3 + NO
(7) 4HClO4 → 2Cl2 + 7O2 + 2H2O
(8) 2H2O2 → 2H2O + O2
(9) Cl2 + Ca(OH)2 → CaOCl2 + H2O
(10) KMnO4 → K2MnO4 + MnO2 + O2
a. Trong số các phản ứng oxi hoá – khử trên, số phản ứng oxi hoá – khử nội phân tử là :
A. 2. B. 3.
C. 4. D. 5.
Hướng dẫn giải:
Các phản ứng oxi hóa – khử nội phân tử: 2; 4;5; 7; 8
⇒ Đáp án D
b. Trong số các phản ứng oxi hoá – khử trên, số phản ứng tự oxi hoá – khử là :
A. 6. B. 7.
C. 4. D. 5.
Hướng dẫn giải:
Các phản ứng oxi hóa – khử nội phân tử: 1; 3; 6; 9; 10
⇒ Đáp án D
-
Ví dụ 2: Cho các phản ứng sau :
Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hoá – khử là ?
A. a, b, d, e, f, h.
B. a, b, d, e, f, g.
C. a, b, c, d, e, g.
D. a, b, c, d, e, h.
Hướng dẫn giải:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa:
a: Fe(+2 → +3) b: Fe(+2 → +3)
d: Cu(0 → +2) e: H2(0 → +1)
f: Ag(+1 → 0) g: Br(0 → -1)
⇒ Đáp án B
-
Dạng 2: Xác định chất khử, chất oxi hóa; quá trình khử, quá trình oxi hóa
Phương pháp giải
+ Chất khử: Là chất nhường electron, sau phản ứng số oxi hóa của nó tăng lên.
+ Chất oxi hóa: Là chất nhận electron, sau phản ứng số oxi hóa của nó giảm xuống.
+ Sự oxi hóa (quá trình oxi hóa): Là sự nhường electron. Như vậy chất khử có quá trình oxi hóa hay bị oxi hóa.
+ Sự khử (quá trình khử): Là sự nhận electron. Như vậy chất oxi hóa có quá trình khử hay bị khử.
+ Sản phẩm khử:Là sản phẩm sinh ra từ quá trình khử.
+ Sản phẩm oxi hóa: Là sản phẩm sinh ra từ quá trình oxi hóa.
Cách nhớ: Đối với chất oxi hóa và chất khử : ″khử cho o nhận″(o là chất oxi hóa). Đối với quá trình oxi hóa, khử : chất oxi hóa tham gia quá trình khử, chất khử tham gia quá trình oxi hóa.
Ví dụ minh họa
-
Ví dụ 1: Cho quá trình : NO3- + 3e + 4H+ → NO + 2H2O
Đây là quá trình :
A. oxi hóa. B. khử.
C. nhận proton. D. tự oxi hóa – khử.
Hướng dẫn giải:
Qúa trình này là quá trình nhận e ⇒ Qúa trình khử
⇒ Đáp án B
Ví dụ 2: Trong các chất sau, chất nào luôn luôn là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử : Fe2O3, I2, O2, FeCl2, HNO3, H2S, SO2 ?
A. KMnO4, I2, HNO3.
B. O2, Fe2O3, HNO3.
C. HNO3, H2S, SO2.
D. FeCl2, I2, HNO3.
Hướng dẫn giải:
Những chất luôn luôn là chất oxi hóa khi tham gia các phản ứng oxi hóa – khử là những chất chứa nguyên tử chưa có số oxi hóa thấp nhất ⇒ Các chất luôn luôn là chất oxi hóa: Fe2O3( Fe+3 → 0 hoặc +2) ; O2 (0 → -2); HNO3 ( N+5 → +4; +2; 0; -3)
⇒ Đáp án B
Ví dụ 3: Trong các chất : FeCl2, FeCl3 , Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
A. 2. B. 3.
C. 5. D. 4.
Hướng dẫn giải:
Chất có tính oxi hóa và tính khử là những chất chứa nguyên tử có số oxi hóa trung bình hoặc chứa 2 nguyên tử của 2 nguyên tố trong đó 1 nguyên tử có số oxi hóa chưa cao nhất và 1 nguyên tử có số oxi hóa chưa thấp nhất ⇒ Chất có cả tính oxi hóa và tính khử: FeCl2; Fe(NO3)2, FeSO4, ( Fe+2 có thể tăng số oxi hóa lên Fe+3 hoặc giảm số oxi hóa xuống Fe0); FeCl3 ( Fe+3 xuống 0 hoặc +2 và Cl- lên 0); Fe(NO3)2( Fe+2 lên Fe+3 và N+5 xuống -3; 0; +1; +2; +4)
⇒ Đáp án B
Ví dụ 4: Cho từng chất : Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là :
A. 8. B. 6.
C. 5. D. 7.
Hướng dẫn giải:
HNO3 đặc nóng là chất oxi hóa nên để xảy ra phản ứng oxi hóa – khử thì các chất tác dụng là chất có tính khử ( chứa nguyên tử có số oxi hóa chưa cao nhất) ⇒ các chất Fe; FeO; Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3
⇒ Đáp án D
-
-
Ví dụ 5: Trong phản ứng dưới đây, vai trò của NO2 là gì ?
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
A. chỉ bị oxi hoá.
B. chỉ bị khử.
C. không bị oxi hóa, không bị khử.
D. vừa bị oxi hóa, vừa bị khử.
Hướng dẫn giải:
Trước phản ứng:
Số oxi hóa của N: +4
Sau phản ứng:
Số oxi hóa của N: +5 ( NaNO3) và +3 (trong NaNO2)
Nguyên tố N (trong NO2) vừa tăng vừa giảm số oxi hóa ⇒ NO2 vừa bị oxi hóa, vừa bị khử
⇒ Đáp án B
Dạng 3: Cân bằng phản ứng oxi hóa – khử
Phương pháp giải
Sử dụng chủ yếu phương pháp thăng bằng electron ( Dựa vào nguyên lí bảo toàn khối lượng và bảo toàn điện tích)
Bước 1 : Xác định số oxi hóa của các nguyên tố trong phản ứng (chỉ nên biểu diễn số oxi hóa của những nguyên tố nào có sự thay đổi số oxi hóa). Từ đó dựa vào dấu hiệu nhận biết để xác định chất oxi hóa, chất khử.
Bước 2 : Viết các quá trình oxi hóa và quá trình khử và cân bằng mỗi quá trình.
Bước 3 : Tìm hệ số thích hợp cho chất oxi hóa và chất khử theo nguyên tắc : Tổng số electron mà chất khử nhường (cho) bằng tổng số electron mà chất oxi hóa nhận. Tức là đi tìm bội số chung nhỏ nhất của số electron cho và số electron nhận, sau đó lấy bội số chung đó chia cho số electron cho hoặc nhận thì được hệ số của chất khử và chất oxi hóa tương ứng.
Bước 4 : Đặt hệ số của chất oxi hóa và chất khử vào phương trình phản ứng. Sau đó chọn hệ số thích hợp cho các chất còn lại trong phản ứng.
Ví dụ minh họa
Ví dụ 1: Cân bằng phương trình phản ứng oxi hóa – khử sau:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Hướng dẫn giải:
Bước 1: Xác định số oxi hóa, chất oxi hóa, chất khử
Chất oxi hóa:
Chất khử:
Bước 2: Viết quá trình oxi hóa, quá trình khử :
Bước 3: Tìm hệ số cho hai quá trình oxi hóa và khử
Bước 4: Đặt hệ số các chất vào phương trình :
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Ví dụ 2: Cân bằng phương trình phản ứng oxi hóa – khử sau:
Hướng dẫn giải:
Bước 1: Xác định số oxi hóa, chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa, quá trình khử :
Bước 3: Tìm hệ số cho hai quá trình oxi hóa và khử
Bước 4: Đặt hệ số chất oxi hóa, chất khử vào phương trình:
Ví dụ 3: Cân bằng các phương trình phản ứng oxi hóa – khử sau :
Hướng dẫn giải:
Bước 1: Xác định số oxi hóa, chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa, quá trình khử :
Bước 3: Tìm hệ số cho hai quá trình oxi hóa và khử
Bước 4: Đặt hệ số các chất và ion vào phương trình kết hợp bảo toàn điện tích:
Ví dụ 4: Trong phản ứng : KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
a. Số phân tử HCl đóng vai trò chất khử là :
A. 8. B. 9.
C. 10. D. 11.
Hướng dẫn giải:
Cân bằng phương trình ta có:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Ta thấy có 10 phân tử Cl- tham gia vào quá trình khử
⇒ Đáp án C
b. Số phân tử HCl đóng vài trò làm môi trường là:
A. 16. B. 10.
C. 6. D. 2.
Hướng dẫn giải:
Tổng số phân tử HCl là 16 trong đó có 10 phân tử HCl tham gia vào quá trình khử
⇒ Có 6 phân tử HCl đóng vai trò làm môi trường
⇒ Đáp án C
Dạng 4: Bài toán về phản ứng oxi hóa khử
Phương pháp giải
Sử dụng phương pháp bảo toàn electron để giải các bài toán nhanh hơn. Chúng ta không cần viết phương trình hóa học, chỉ cần xác định quá trình khử và quá trình hóa và vận dụng công thức bảo toàn electron:
ne nhường = ne nhận
Ví dụ minh họa
Ví dụ 1: Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm khử X. X là
A. SO2. B. S.
C. H2S. D. SO2, H2S.
Hướng dẫn giải:
Dung dịch H2SO4 đậm đặc vừa là chất oxi hóa vừa là môi trường.
Gọi a là số oxi hóa của S trong X.
nH2SO4 phản ứng = 49/98 = 0,5 mol
nH2SO4 tạo muối = nMg = 0,4 mol
⇒ nH2SO4 bị khử = 0,5 – 0,4 = 0,1 mol
⇒ ne nhận = 0,1.(6 - a) = ne cho = 0,8
⇒ a = -2 ⇒ X là H2S
Do đó X là H2S
Ví dụ 2: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy (sản phẩm khử duy nhất ở đktc) có tỉ khối đối với H2 bằng 22. Khí NxOy và kim loại M là:
A. NO và Mg B. N2O và Al
C. N2O và Fe D. NO2 và Al
Hướng dẫn giải:
MNxOy = 22.2 = 44(gam/mol)
⇒ NxOy là N2O
Có
Gọi n là hóa trị của kim loại M. Các quá trình nhuờng và nhận electron:
Quá trình nhường electron:
Quá trình nhận electron:
Áp dụng định luật bảo toàn mol electron, ta có: n.nM = 8nN2O
⇒ Đáp án B
-
Ví dụ 3: 0,15 mol FexOy tác dụng với HNO3 đun nóng, thoát ra 0,05 mol NO. Công thức oxit sắt là
A. FeO. B. Fe2O3.
C. Fe3O4. D. FeO hoặc Fe3O4.
Hướng dẫn giải:
Bảo toàn e ta có:
0,15(3x-2y) = 0,15 ⇒ 3x – 2y = 1
⇒ x = 1 và y = 1 hoặc x = 3 và y = 4
⇒ Đáp án D