Quảng cáo
1 câu trả lời 14221
Giải chi tiết:
Phần (a): Tính nồng độ mol của ion H+ trong dung dịch A
Bước 1: Tính số mol H2SO4 ban đầu
Khối lượng dung dịch H2SO4 ban đầu:
![]()
Nồng độ phần trăm:
![]()
Khối lượng chất tan H2SO4:
![]()
Khối lượng mol của H2SO4:
![]()
Số mol :
![]()
Bước 2: Tính nồng độ mol của H2SO4 trong dung dịch A
Thể tích dung dịch A:
![]()
Nồng độ mol:
![]()
Bước 3: Tính nồng độ mol của ion H+
Do H2SO4 phân ly hoàn toàn theo hai nấc:
![]()
Với mỗi mol H2SO4, ta thu được 2 mol H+. Nồng độ ion H+:
![]()
Phần (b): Tính thể tích dung dịch NaOH cần thêm vào 0,5lít dung dịch A
Trường hợp 1: Dung dịch có pH = 1
Số mol H+ trong dung dịch ban đầu:
![]()
Tính số mol H+ còn lại khi pH = 1:
![]()
Tổng thể tích dung dịch sau phản ứng:
![]()
Số mol H+ còn lại:
![]()
Phương trình phản ứng trung hòa:
![]()
Số mol OH- từ NaOH:
![]()
Sau phản ứng:
![]()
Ta có:
![]()
Giải phương trình:
![]()
Trường hợp 2: Dung dịch có pH = 13
Tính số mol OH- cần có khi pH = 13:
![]()
Tổng thể tích dung dịch:
![]()
Số mol OH-:
![]()
Số mol OH- dư:
![]()
Phương trình:
![]()
Giải phương trình:
![]()
Kết quả:
- (a) Nồng độ mol của H+: 2M.
(b) Thể tích NaOH: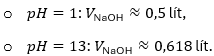
Quảng cáo
Bạn muốn hỏi bài tập?
Câu hỏi hot cùng chủ đề
-
Hỏi từ APP VIETJACK64705
-
Hỏi từ APP VIETJACK44807


